基因敲除结核杆菌助力研究细胞焦亡的信号通路
上海晶诺生物科技有限公司
1935
2020 年 10 月 21 日,武汉大学章晓联、殷雷老师作为共同通讯作者在 Science Advances 在线发表研究成果 “Mycobacterial EST12 activates a RACK1–NLRP3–gasdermin D pyroptosis–IL-1β immune pathway”,该研究鉴定了一种从 M. tb H37Rv 分泌的细胞焦亡诱导蛋白 EST12(Rv1579c)。

导读:
细胞焦亡是一种程序性细胞死亡的炎性形式,与消除病原体感染有关。该文章介绍了一种诱导巨噬细胞焦亡的结核蛋白 EST12。EST12 结合巨噬细胞中活化的 C 激酶 1(RACK1)的受体,EST12-RACK1 复合体募集去泛素化酶 UCHL5 来促进 NLRP3 的 K48 连接去泛素化,随后导致 NLRP3–caspase-1/11–GSDMD–IL-1β免疫过程。EST12 晶体结构分析表明,氨基酸 Y80 是 RACK1 的关键结合位点。EST12 敲除菌株在体内或体外 MTB 感染中都显示出了高易感性。该研究首次证明了 RACK1 作为病原体的内源宿主感应蛋白,并且 EST12-RACK1 诱导的细胞焦亡在 M.tb 诱导的免疫中起关键作用。
研究内容:
1、RD 区编码蛋白筛选:对 40 种 RD 区(RD1-3、11-14)重组蛋白进行筛选(巨噬细胞焦磷酸相关蛋白),通过 LDH 释放实验细胞毒性分析,发现 EST12 对巨噬细胞有显著焦解作用。
2、菌株构建:构建 M. tb H37Rv ΔEST12(Rv1579c 敲除菌株)、BCG-EST12(Rv1579c 过表达菌株)、M. smeg–EST12(Rv1579c 过表达菌株)。
3、小鼠基因敲除模型:NLRP3−/−、GSDMD−/−、caspase-1/11−/−小鼠、RACK1ΔMΦ。
4、检测内容:LDH(乳酸脱氢酶)释放实验检测细胞毒性、ELISA 检测细胞因子分泌、WB 检测、免疫沉淀(IP)、pull down、质谱、EST12 晶体结构、共聚焦显微镜、小鼠结核感染模型等。
研究结果:
1、EST12(Rv1579c)诱导 GSDMD 介导的巨噬细胞焦亡
表达纯化 40 种 RD 区编码蛋白,通过 LDH 释放实验,发现 EST12(Rv1579c)具有明显的巨噬细胞毒性作用。EST12 蛋白导致小鼠腹腔巨噬细胞(图 1A 和 B)、人单核细胞 THP-1(图 1C)和小鼠骨髓来源巨噬细胞(BMDMs)死亡(图 1D)。结果表明,EST12 对巨噬细胞具有较强的毒性。
上海晶诺生物科技有限公司专注于结核分枝杆菌相关研究,专业提供结核分枝杆菌突变体构建技术服务和产品,已多次助力科研团队攻关重要结核基础研究工作!目前晶诺已完成将近1800个结核分枝杆菌基因敲除菌株,还在持续更新中!请联系我们了解更多信息!
上海晶诺生物科技有限公司
电话:0757-29328131
手机/微信:13392273325
Q Q:2775427010

导读:
细胞焦亡是一种程序性细胞死亡的炎性形式,与消除病原体感染有关。该文章介绍了一种诱导巨噬细胞焦亡的结核蛋白 EST12。EST12 结合巨噬细胞中活化的 C 激酶 1(RACK1)的受体,EST12-RACK1 复合体募集去泛素化酶 UCHL5 来促进 NLRP3 的 K48 连接去泛素化,随后导致 NLRP3–caspase-1/11–GSDMD–IL-1β免疫过程。EST12 晶体结构分析表明,氨基酸 Y80 是 RACK1 的关键结合位点。EST12 敲除菌株在体内或体外 MTB 感染中都显示出了高易感性。该研究首次证明了 RACK1 作为病原体的内源宿主感应蛋白,并且 EST12-RACK1 诱导的细胞焦亡在 M.tb 诱导的免疫中起关键作用。
研究内容:
1、RD 区编码蛋白筛选:对 40 种 RD 区(RD1-3、11-14)重组蛋白进行筛选(巨噬细胞焦磷酸相关蛋白),通过 LDH 释放实验细胞毒性分析,发现 EST12 对巨噬细胞有显著焦解作用。
2、菌株构建:构建 M. tb H37Rv ΔEST12(Rv1579c 敲除菌株)、BCG-EST12(Rv1579c 过表达菌株)、M. smeg–EST12(Rv1579c 过表达菌株)。
3、小鼠基因敲除模型:NLRP3−/−、GSDMD−/−、caspase-1/11−/−小鼠、RACK1ΔMΦ。
4、检测内容:LDH(乳酸脱氢酶)释放实验检测细胞毒性、ELISA 检测细胞因子分泌、WB 检测、免疫沉淀(IP)、pull down、质谱、EST12 晶体结构、共聚焦显微镜、小鼠结核感染模型等。
研究结果:
1、EST12(Rv1579c)诱导 GSDMD 介导的巨噬细胞焦亡
表达纯化 40 种 RD 区编码蛋白,通过 LDH 释放实验,发现 EST12(Rv1579c)具有明显的巨噬细胞毒性作用。EST12 蛋白导致小鼠腹腔巨噬细胞(图 1A 和 B)、人单核细胞 THP-1(图 1C)和小鼠骨髓来源巨噬细胞(BMDMs)死亡(图 1D)。结果表明,EST12 对巨噬细胞具有较强的毒性。

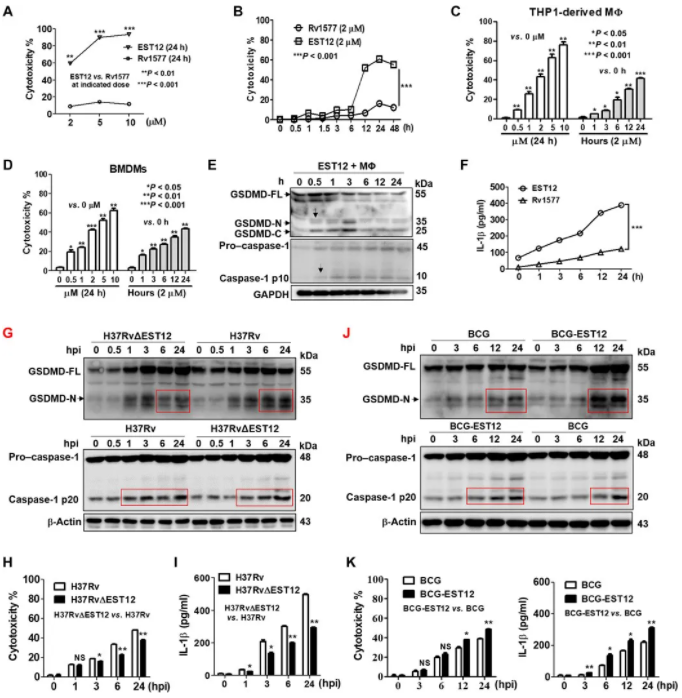
图 1 巨噬细胞焦亡诱导蛋白 EST12 的鉴定
A-D:分别用 EST12 和 Rv1577 处理小鼠腹腔巨噬细胞(A、B)、PMA 分化的 THP1 细胞(C)、小鼠骨髓巨噬细胞 BMDMS(D),采用 LDH 释放法分析。E:WB 检测 2μM EST12 或 RV1577 处理巨噬细胞 GSDMD 活化;F:ELISA 检测 IL-1β分泌;G:WB 检测 H37Rv 和 H37RvΔEST12 感染 BMDMs 细胞后 caspase-1/GSDMD 活性;H:LDH 释放实验检测细胞毒性;I:ELISA 检测 IL-1β分泌;J:WB 检测 BCG 和 BCG-EST12 感染 BMDMs 细胞后 caspase-1/GSDMD 活性;K:LDH 释放实验检测细胞毒性,ELISA 检测 IL-1β分泌。
为确定 GSDMD 和 GSDME 是否参与 EST12 诱导的细胞死亡,2μM EST12 刺激小鼠腹腔巨噬细胞不同时间,检测 GSDMD 和 GSDME 活性。发现 2μM EST12 刺激小鼠腹腔巨噬细胞 0.5 小时 GSDMD 全长、GSDMD N 端和 C 端被检测到,caspase-1 P20 片段裂解活性增强(图 1E),巨噬细胞 IL-1β分泌增加(1F),EST12 进一步处理人 THP-1 单核细胞来源巨噬细胞,发现 caspase-1 和 GSDMD 被 EST12 裂解。
检测 H37Rv 和 H37RvΔEST12 感染巨噬细胞 caspase-1 和 GSDMD 活性,H37Rv∆EST12 组与 H37Rv 组在感染后 1 小时内无明显变化。在刺激 6h 后,H37Rv 在 BMDMs 中诱导了更多裂解的 caspase-1 p20 和 GSDMD-N 末端片段(图 1G)。与之类似,H37Rv∆EST12 组 LDH 释放和 IL-1β分泌低于 H37Rv 组(图 1H、I)。结果表明,H37Rv∆EST12 组造成的炎性焦亡少于 H37Rv 组。在 BMDMs 中,与 BCG 相比 BCG-EST12 持续诱导更多的 caspase-1 p20 和 GSDMD-N 末端片段(图 1J),细胞毒性和 IL-1 分泌量更高(图 1K)。结果表明,重组 BCG-EST12 较 BCG 诱导 IL-1β表达量和细胞毒性显著升高。
结果小结:EST12 通过 GSDMD 介导巨噬细胞焦亡和炎性细胞因子 IL-1 分泌。
2、EST12 与 RACK1 相互作用诱导巨噬细胞炎性焦亡
为检测细胞中与 EST12 相互作用蛋白,使用 pull down 实验和质谱检测,结果发现 RACK1 蛋白可能是与 EST12 的结合蛋白,免疫印迹进一步验证了这个结果(图 2A)。将 EST12-绿色荧光和 RACK1-红色荧光蛋白表达质粒转染到巨噬细胞 RAW264.7 中,共聚焦荧光显微镜显示 EST12 和 RACK1 在细胞质中定位,产生黄色(图 2B)。qPCR 和 WB 分析结果显示,EST12 刺激巨噬细胞 RACK1 的表达,在 6h 时达到峰值,然后下降(图 2C), 推测 EST12 在早期促进 RACK1 的表达。

为确定 GSDMD 和 GSDME 是否参与 EST12 诱导的细胞死亡,2μM EST12 刺激小鼠腹腔巨噬细胞不同时间,检测 GSDMD 和 GSDME 活性。发现 2μM EST12 刺激小鼠腹腔巨噬细胞 0.5 小时 GSDMD 全长、GSDMD N 端和 C 端被检测到,caspase-1 P20 片段裂解活性增强(图 1E),巨噬细胞 IL-1β分泌增加(1F),EST12 进一步处理人 THP-1 单核细胞来源巨噬细胞,发现 caspase-1 和 GSDMD 被 EST12 裂解。
检测 H37Rv 和 H37RvΔEST12 感染巨噬细胞 caspase-1 和 GSDMD 活性,H37Rv∆EST12 组与 H37Rv 组在感染后 1 小时内无明显变化。在刺激 6h 后,H37Rv 在 BMDMs 中诱导了更多裂解的 caspase-1 p20 和 GSDMD-N 末端片段(图 1G)。与之类似,H37Rv∆EST12 组 LDH 释放和 IL-1β分泌低于 H37Rv 组(图 1H、I)。结果表明,H37Rv∆EST12 组造成的炎性焦亡少于 H37Rv 组。在 BMDMs 中,与 BCG 相比 BCG-EST12 持续诱导更多的 caspase-1 p20 和 GSDMD-N 末端片段(图 1J),细胞毒性和 IL-1 分泌量更高(图 1K)。结果表明,重组 BCG-EST12 较 BCG 诱导 IL-1β表达量和细胞毒性显著升高。
结果小结:EST12 通过 GSDMD 介导巨噬细胞焦亡和炎性细胞因子 IL-1 分泌。
2、EST12 与 RACK1 相互作用诱导巨噬细胞炎性焦亡
为检测细胞中与 EST12 相互作用蛋白,使用 pull down 实验和质谱检测,结果发现 RACK1 蛋白可能是与 EST12 的结合蛋白,免疫印迹进一步验证了这个结果(图 2A)。将 EST12-绿色荧光和 RACK1-红色荧光蛋白表达质粒转染到巨噬细胞 RAW264.7 中,共聚焦荧光显微镜显示 EST12 和 RACK1 在细胞质中定位,产生黄色(图 2B)。qPCR 和 WB 分析结果显示,EST12 刺激巨噬细胞 RACK1 的表达,在 6h 时达到峰值,然后下降(图 2C), 推测 EST12 在早期促进 RACK1 的表达。

图 2 EST12 与 RACK1 相互作用诱导巨噬细胞炎性焦亡
A:RAW264.7 细胞进行 EST12-His pull-down 实验,WB 分析;B:共聚焦显微镜分析分别转染 pEGFP-C1-EST12 和 pAsRED2-C1-RACK1 的 RAW264.7 细胞;C:WB 和 qPCR 分析 2μM EST12 刺激的 RAW264.7 细胞;D、E:LDH、ELISA 分析 2μM EST12 处理 WT 和 RACK1−/−腹腔巨噬细胞上清;F:WB 检测细胞裂解液中 GSDMD 和 caspase-1;G:2μM EST12 处理和 PI 染色 WT、RACK1−/−巨噬细胞;E-J:LDH、ELISA 分析 H37Rv 和 H37RvΔEST12、BCG 和 BCG-EST12、M. smeg 和 M. smeg-EST12 感染 WT、RACK1−/−BMDMs。
研究 EST12 与 RACK1 在巨噬细胞中相互作用,2μM EST12 分别刺激 WT 和 RACK1−/−腹腔巨噬细胞,与 WT 巨噬细胞相比,RACK1−/−腹腔巨噬细胞中 EST12 诱导的细胞毒性(图 2D)和 IL-1 分泌(图 2E)显著降低,GSDMD N 片段和 caspase-1 p10 裂解被强烈抑制(图 2F)。实时共焦显微镜分析显示,EST12 导致腹腔巨噬细胞呈现典型的细胞焦亡形态:质膜破裂,多个泡状突起,细胞核内呈 “煎蛋” 状(图 2G)。H37RvΔEST12 感染 WT BMDMs 和 H37Rv 感染 RACK1−/−BMDMs 的细胞凋亡和 IL-1β分泌无区别(图 2H)。BCG-EST12 和 BCG 感染 RACK1−/−BMDMs 的细胞毒性和 IL-1β分泌无明显区别(图 2I)。M. smeg 和 M. smeg-EST12 实验组也是同样结果(图 2J)
结果小结:EST12 通过 RACK1 引起巨噬细胞炎性焦亡。
3、EST12 蛋白 C 端和 Y80 是与 RACK1 结合的关键位点
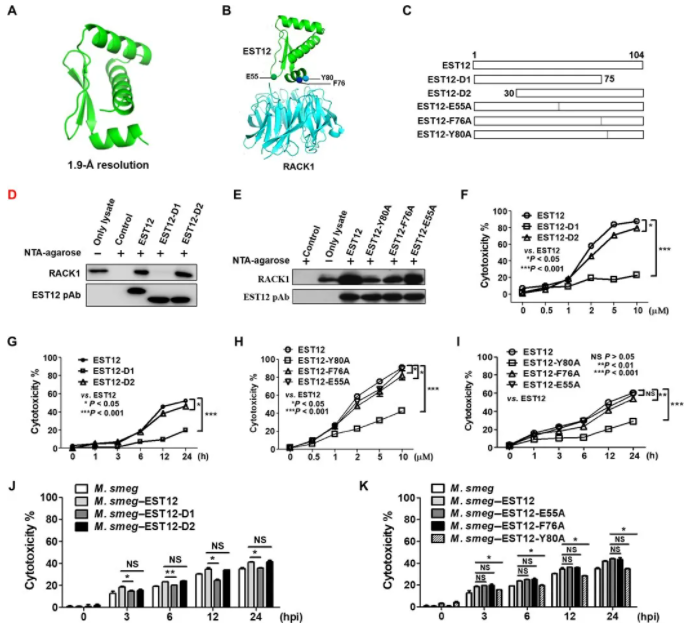
对 EST12-RACK1 结构预测(图 3B),EST12 与 RACK1 的相互作用可能依赖于 EST12 的第三个螺旋状结构(E55、F76、Y80)。重组蛋白(图 3C)对 RAW264.7 细胞裂解物进行 pull down 实验,然后免疫印迹分析,与 EST12 和 EST12-D2 蛋白相比,EST12-D1(C 端缺失)与 RACK1 几乎没有相互作用(图 3D),Y80A 和 F76A 与 RACK1 的结合作用明显低于 EST12(图 3E)。与 EST12 相比,EST12-D1 的细胞毒性作用也明显减弱(图 3F、G),EST12-E55A、F76A、Y80A 诱导的细胞毒性作用下降,其中 EST12-Y80A 最为明显(图 3H、I)。同样,M. smeg-EST1-D1 和 M. smeg-EST12-Y80A 感染引起的细胞焦亡较 M. smeg-EST12 减少(图 3J、K)。
结果小结:EST12 C 端的 Y80 是 RACK1 引起焦亡的关键结合位点。
研究 EST12 与 RACK1 在巨噬细胞中相互作用,2μM EST12 分别刺激 WT 和 RACK1−/−腹腔巨噬细胞,与 WT 巨噬细胞相比,RACK1−/−腹腔巨噬细胞中 EST12 诱导的细胞毒性(图 2D)和 IL-1 分泌(图 2E)显著降低,GSDMD N 片段和 caspase-1 p10 裂解被强烈抑制(图 2F)。实时共焦显微镜分析显示,EST12 导致腹腔巨噬细胞呈现典型的细胞焦亡形态:质膜破裂,多个泡状突起,细胞核内呈 “煎蛋” 状(图 2G)。H37RvΔEST12 感染 WT BMDMs 和 H37Rv 感染 RACK1−/−BMDMs 的细胞凋亡和 IL-1β分泌无区别(图 2H)。BCG-EST12 和 BCG 感染 RACK1−/−BMDMs 的细胞毒性和 IL-1β分泌无明显区别(图 2I)。M. smeg 和 M. smeg-EST12 实验组也是同样结果(图 2J)
结果小结:EST12 通过 RACK1 引起巨噬细胞炎性焦亡。
3、EST12 蛋白 C 端和 Y80 是与 RACK1 结合的关键位点
对 EST12-RACK1 结构预测(图 3B),EST12 与 RACK1 的相互作用可能依赖于 EST12 的第三个螺旋状结构(E55、F76、Y80)。重组蛋白(图 3C)对 RAW264.7 细胞裂解物进行 pull down 实验,然后免疫印迹分析,与 EST12 和 EST12-D2 蛋白相比,EST12-D1(C 端缺失)与 RACK1 几乎没有相互作用(图 3D),Y80A 和 F76A 与 RACK1 的结合作用明显低于 EST12(图 3E)。与 EST12 相比,EST12-D1 的细胞毒性作用也明显减弱(图 3F、G),EST12-E55A、F76A、Y80A 诱导的细胞毒性作用下降,其中 EST12-Y80A 最为明显(图 3H、I)。同样,M. smeg-EST1-D1 和 M. smeg-EST12-Y80A 感染引起的细胞焦亡较 M. smeg-EST12 减少(图 3J、K)。
结果小结:EST12 C 端的 Y80 是 RACK1 引起焦亡的关键结合位点。

图 3 Y80 是 RACK1 的关键结合位点
A:EST12 晶体结构;B:EST12-RACK1 预测结构;C:重组蛋白全长、EST12 C 端缺失(EST12- D1)、N 端缺失(EST12- D2)、EST12 的 3 个突变体图示;D-E:重组蛋白 pull down 及 WB 分析;F-I:LDH 分析重组蛋白不同时间、不同剂量处理腹腔巨噬细胞;J-K:LDH 分析 M. smeg 和 M. smeg-est12、EST12-D1、EST12-D2、EST12-E55A、EST12-F76A、EST12-Y80A 感染 BMDMs。
4、EST12-RACK1 通过 NLRP3 和 GSDMD 引起巨噬细胞焦亡和 IL-1 分泌
炎症小体的激活是对抗细菌感染的关键防御机制,细菌感染可诱发先天性免疫反应,如 caspase-1 激活和炎症细胞死亡。mRNA 芯片分析 EST12 处理 RAW264.7 细胞,结果显示 NLRP3、IL-1β、IL-6 和 TNF-α表达上调。8 个 PYRIN 结构域蛋白(NLRP1b、NLRP2、NLRP3、NLRP5、NLRP6、NLRP9、NLRP12、PYRIN)通过 EST12 处理后,NLRP3 的 mRNA 表达在巨噬细胞显著改变(图 4A)。在 EST12 刺激 6 小时后,免疫印迹分析 NLRP3 蛋白表达上升达到最高(图 4B)。共聚焦显微镜分析显示,NLRP3 表达在 EST12 刺激后 6 小时最高(图 4C)。EST12 处理后,RACK1−/−中 NLRP3 表达明显受损(图 4D)。
结果小结:EST12 导致 NLRP3 的表达依赖于 RACK1。

4、EST12-RACK1 通过 NLRP3 和 GSDMD 引起巨噬细胞焦亡和 IL-1 分泌
炎症小体的激活是对抗细菌感染的关键防御机制,细菌感染可诱发先天性免疫反应,如 caspase-1 激活和炎症细胞死亡。mRNA 芯片分析 EST12 处理 RAW264.7 细胞,结果显示 NLRP3、IL-1β、IL-6 和 TNF-α表达上调。8 个 PYRIN 结构域蛋白(NLRP1b、NLRP2、NLRP3、NLRP5、NLRP6、NLRP9、NLRP12、PYRIN)通过 EST12 处理后,NLRP3 的 mRNA 表达在巨噬细胞显著改变(图 4A)。在 EST12 刺激 6 小时后,免疫印迹分析 NLRP3 蛋白表达上升达到最高(图 4B)。共聚焦显微镜分析显示,NLRP3 表达在 EST12 刺激后 6 小时最高(图 4C)。EST12 处理后,RACK1−/−中 NLRP3 表达明显受损(图 4D)。
结果小结:EST12 导致 NLRP3 的表达依赖于 RACK1。

图 4 EST12 通过 RACK1 诱导 NLRP3 炎症小体的激活
A:qPCR 分析 EST12 蛋白处理的小鼠腹腔巨噬细胞 8 个 PYRIN 结构域蛋白的 mRNA 表达水平;B-C:WB 和共聚焦显微镜检测 EST12 蛋白刺激的 RAW264.7 细胞;D:qPCR 分析 EST12 处理 WT 和 RACK1−/−腹腔巨噬细胞的 NLRP3 mRNA 表达水平;E:IP 和 WB 分析质粒转染后 EST12 刺激的 RAW264.7 细胞;F:WB 分析裂解的 BMDMs 细胞的 pull down 蛋白;G-J:IP 和 WB 分析 EST12 处理的 BMDMs 细胞;K:共聚焦显微镜分析 EST12 处理后的 WT 和 RACK1−/−腹腔巨噬细胞;L:IP 和 IB 分析 EST12 处理或未预处理的腹腔巨噬细胞。
将编码 WT 泛素(H-Ub)、突变 H-Ub(K48)和 H-Ub(K63)质粒转染至 RAW264.7 细胞,通过 IP 和 WB 实验,推测 EST12 介导了 K48 连接的 NLRP3 去泛素化(图 4E)。WB 分析 EST12 处理的 RAW 264.7 细胞裂解液 pull down 蛋白,进一步验证 EST12 和去泛素酶 UCHL5 的相互作用(图 4F)。通过免疫共沉淀分析,发现在 EST12 处理后,NLRP3 和 RACK1 均直接与 UCHL5 相互作用(图 4,G-I),而 EST12-Y80A 处理不能促进 RACK1 与 UCHL5、NLRP3 的相互作用(图 4,H 和 I)。UCHL5 敲低株在 EST12 刺激后,NLRP3 的 K48 去泛素化明显降低(图 4J),结果表明 EST12 刺激后通过 UCHL5 介导 NLRP3 K48 连接的去泛素化。免疫荧光分析发现 EST12 存在时 ASC 斑点的形成,但在 EST12 处理的 RACK1−/−腹腔巨噬细胞中却没有发现(图 4K)。IP 和 WB 实验发现 NLRP3 可以同时沉淀 ASC 和 pro-caspase-1,ASC 也可以沉淀 NLRP3 和 pro-caspase-1(图 4L)。
结果小结:在 EST12 处理后,NLRP3、ASC 和 pro-caspase-1 可以组装成 NLRP3 炎性小体。
将编码 WT 泛素(H-Ub)、突变 H-Ub(K48)和 H-Ub(K63)质粒转染至 RAW264.7 细胞,通过 IP 和 WB 实验,推测 EST12 介导了 K48 连接的 NLRP3 去泛素化(图 4E)。WB 分析 EST12 处理的 RAW 264.7 细胞裂解液 pull down 蛋白,进一步验证 EST12 和去泛素酶 UCHL5 的相互作用(图 4F)。通过免疫共沉淀分析,发现在 EST12 处理后,NLRP3 和 RACK1 均直接与 UCHL5 相互作用(图 4,G-I),而 EST12-Y80A 处理不能促进 RACK1 与 UCHL5、NLRP3 的相互作用(图 4,H 和 I)。UCHL5 敲低株在 EST12 刺激后,NLRP3 的 K48 去泛素化明显降低(图 4J),结果表明 EST12 刺激后通过 UCHL5 介导 NLRP3 K48 连接的去泛素化。免疫荧光分析发现 EST12 存在时 ASC 斑点的形成,但在 EST12 处理的 RACK1−/−腹腔巨噬细胞中却没有发现(图 4K)。IP 和 WB 实验发现 NLRP3 可以同时沉淀 ASC 和 pro-caspase-1,ASC 也可以沉淀 NLRP3 和 pro-caspase-1(图 4L)。
结果小结:在 EST12 处理后,NLRP3、ASC 和 pro-caspase-1 可以组装成 NLRP3 炎性小体。

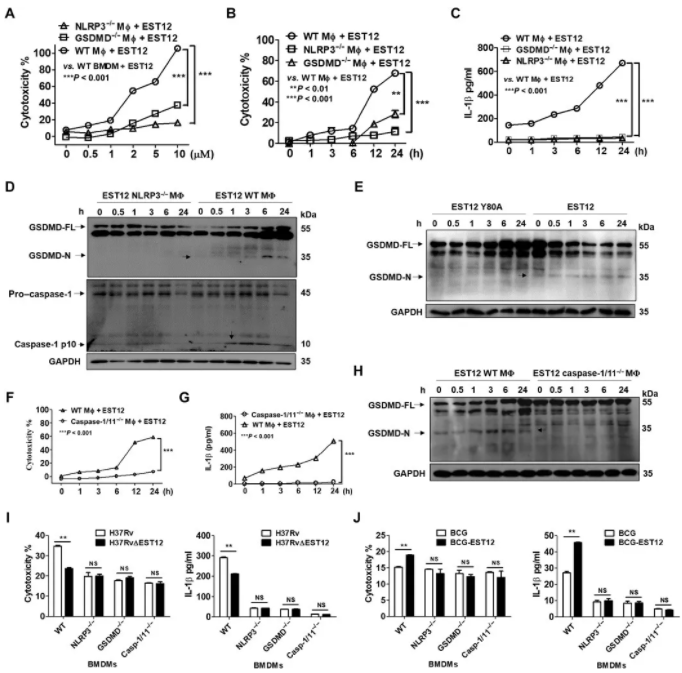
图 5 EST12-RACK1 通过 NLRP3 和 GSDMD 引起巨噬细胞焦亡和 IL-1 分泌
A-C:LDH、ELISA 分析 EST12 处理的 WT、NLRP3-/-和 GSDMD-/-腹腔巨噬细胞毒性分析及 IL-1β分泌;D:WB 检测 EST12 处理的 WT、NLRP3-/-腹腔巨噬 GSDMD 和 caspase-1 的活性;E:WB 检测 EST12 和 EST12-Y80A 处理的腹腔巨噬细胞 GSDMD 的活性;F-H:LDH、ELISA、WB 检测 EST12 处理 WT 和 caspase-1/11−/−腹腔巨噬细胞毒性分析、IL-1β分泌及 GSDMD 的活性;I、J:LDH、ELISA 分析 H37Rv、H37RvΔEST12 及 BCG、BCG-EST12 感染 WT、NLRP3−/−、GSDMD−/−和 caspase-1/11−/−BMDMs 细胞 6 小时后细胞毒性和 IL-1β分泌。
ST12 处理 GSDMD−/−或 NLRP3−/−小鼠的腹腔巨噬细胞,与 WT 小鼠腹腔巨噬细胞相比,细胞毒性相比明显下降(图 5A、B);上清中未检测到 IL-1β(图 5C);检测 EST12 对 NLRP3−/−腹腔巨噬细胞 caspase-1 和 GSDMD 裂解的影响,发现两者均未显示活化作用(图 5D)。EST12-Y80A 处理 WT 巨噬细胞未裂解 GSDMD(图 5E)。IL-1β分泌明显降低(图 5F、G),未观察到 GSDMD 的裂解(图 5H),结果表明 EST12 通过 caspase-1 引发巨噬细胞 GSDMD 介导的焦解和 IL-1 分泌。H37Rv 与 H37RvΔEST12 感染 NLRP3−/−、GSDMD−/−、caspase-1/11−/−BMDMs 细胞毒性、IL-1β分泌并无差异,除 WT BMDMs(图 5I)。BCG-EST12 和 BCG 感染也是类似情况。
结果小结:EST12-Y80 通过 RACK1、NLRP3、GSDMD、caspase-1 触发巨噬细胞焦亡和 IL-1 分泌。
5、EST12 激活宿主免疫反应,增强分枝杆菌清除
在感染过程中,被感染巨噬细胞的焦亡作用是激活宿主免疫系统的必要条件。构建 M.tb H37Rv 和 H37RvΔEST12 小鼠感染模型,感染 30 天后,进行肺部菌落计数、血清中 IL-1β检测及肺部切片抗酸染色(图 6A-C)。肺部切片 HE 染色病理学分析中,H37RvΔEST12 感染组相较于 H37Rv 组,淋巴细胞浸润增多、肺泡间隔变小(图 6D)。BCG-EST12 相较于 BCG 感染的小鼠肺部载菌量降低(图 6E)、IL-1β分泌增加(图 6F),病理分析显示感染 BCG 组肺泡组织损伤较 BCG-EST12 组严重(图 6G)。对不同细菌感染后的 WT BMDMs 进行菌落计数,在 WT BMDMs 中,BCG-EST12 感染与 BCG 组相比,在 3 和 6 hpi 时 CFUs 更少(图 6H)。BCG-EST12 和 BCG 感染 RACK1−/−,NLRP3−/−,GSDMD−/−和 caspase-1/11−−/BMDMs 后,菌落计数没有不同(图 6I、J)。
结果小结:EST12 增加了巨噬细胞和小鼠对 M. tb 感染抵抗力 , 它通过 RACK1-、NLRP3、GSDMD 和 caspase-1/11-介导的炎症焦亡在 M. tb 诱导免疫中扮演关键的角色。

ST12 处理 GSDMD−/−或 NLRP3−/−小鼠的腹腔巨噬细胞,与 WT 小鼠腹腔巨噬细胞相比,细胞毒性相比明显下降(图 5A、B);上清中未检测到 IL-1β(图 5C);检测 EST12 对 NLRP3−/−腹腔巨噬细胞 caspase-1 和 GSDMD 裂解的影响,发现两者均未显示活化作用(图 5D)。EST12-Y80A 处理 WT 巨噬细胞未裂解 GSDMD(图 5E)。IL-1β分泌明显降低(图 5F、G),未观察到 GSDMD 的裂解(图 5H),结果表明 EST12 通过 caspase-1 引发巨噬细胞 GSDMD 介导的焦解和 IL-1 分泌。H37Rv 与 H37RvΔEST12 感染 NLRP3−/−、GSDMD−/−、caspase-1/11−/−BMDMs 细胞毒性、IL-1β分泌并无差异,除 WT BMDMs(图 5I)。BCG-EST12 和 BCG 感染也是类似情况。
结果小结:EST12-Y80 通过 RACK1、NLRP3、GSDMD、caspase-1 触发巨噬细胞焦亡和 IL-1 分泌。
5、EST12 激活宿主免疫反应,增强分枝杆菌清除
在感染过程中,被感染巨噬细胞的焦亡作用是激活宿主免疫系统的必要条件。构建 M.tb H37Rv 和 H37RvΔEST12 小鼠感染模型,感染 30 天后,进行肺部菌落计数、血清中 IL-1β检测及肺部切片抗酸染色(图 6A-C)。肺部切片 HE 染色病理学分析中,H37RvΔEST12 感染组相较于 H37Rv 组,淋巴细胞浸润增多、肺泡间隔变小(图 6D)。BCG-EST12 相较于 BCG 感染的小鼠肺部载菌量降低(图 6E)、IL-1β分泌增加(图 6F),病理分析显示感染 BCG 组肺泡组织损伤较 BCG-EST12 组严重(图 6G)。对不同细菌感染后的 WT BMDMs 进行菌落计数,在 WT BMDMs 中,BCG-EST12 感染与 BCG 组相比,在 3 和 6 hpi 时 CFUs 更少(图 6H)。BCG-EST12 和 BCG 感染 RACK1−/−,NLRP3−/−,GSDMD−/−和 caspase-1/11−−/BMDMs 后,菌落计数没有不同(图 6I、J)。
结果小结:EST12 增加了巨噬细胞和小鼠对 M. tb 感染抵抗力 , 它通过 RACK1-、NLRP3、GSDMD 和 caspase-1/11-介导的炎症焦亡在 M. tb 诱导免疫中扮演关键的角色。

图6 EST12激活宿主免疫反应增加分枝杆菌清除
A:小鼠感染 H37Rv、H37RvΔEST12 菌株 30 天后,肺部菌落计数;B:ELISA 检测血清中 IL-1β;C:H37Rv、H37RvΔEST12 感染小鼠肺部切片抗酸染色;D:H37Rv、H37RvΔEST12 感染小鼠肺部切片 HE 染色;E:小鼠感染 BCG、BCG-EST12 肺部菌落计数;F:ELISA 检测血清中 IL-1β;G:BCG、BCG-EST12 感染小鼠肺部切片 HE 染色;H-J:WT(H)和 RACK1−/−(J) BMDMs 感染 BCG 和 BCG-EST12 或 WT,NLRP3−/−,GSDMD−/−,caspase-1/11−/−BMDMs(I)感染 6 小时菌落计数。
结论:
EST12 通过与巨噬细胞 RACK1 相互作用而引起细胞焦亡。RACK1 作为检测 M. tb EST12 的主要宿主因子,并招募去泛素酶 UCHL5 促进 NLRP3 去泛素化,进而激活巨噬细胞 NLRP3 炎性小体-caspase-1-GSDMD 细胞焦亡-IL-1β分子免疫通路。该研究阐释了巨噬细胞与 EST12 之间的相互作用,并证实了 EST12-RACK1 诱导的细胞焦亡在 M. tb 诱导免疫中的关键作用。

结论:
EST12 通过与巨噬细胞 RACK1 相互作用而引起细胞焦亡。RACK1 作为检测 M. tb EST12 的主要宿主因子,并招募去泛素酶 UCHL5 促进 NLRP3 去泛素化,进而激活巨噬细胞 NLRP3 炎性小体-caspase-1-GSDMD 细胞焦亡-IL-1β分子免疫通路。该研究阐释了巨噬细胞与 EST12 之间的相互作用,并证实了 EST12-RACK1 诱导的细胞焦亡在 M. tb 诱导免疫中的关键作用。

晶诺生物为本研究构建了EST12敲除菌株并提供相关技术支持
上海晶诺生物科技有限公司专注于结核分枝杆菌相关研究,专业提供结核分枝杆菌突变体构建技术服务和产品,已多次助力科研团队攻关重要结核基础研究工作!目前晶诺已完成将近1800个结核分枝杆菌基因敲除菌株,还在持续更新中!请联系我们了解更多信息!
文献来源:
https://advances.sciencemag.org/content/6/43/eaba4733
上海晶诺生物科技有限公司
电话:0757-29328131
手机/微信:13392273325
Q Q:2775427010