用光改变世界,光遗传学技术原理及光敏蛋白全介绍
和元生物技术(上海)股份有限公司
光遗传学(optogenetics)是结合了光学(optics)及遗传学(genetics)的技术,借助其,我们能在活体动物甚至是自由运动的动物脑内、脊髓、外周神经内,精准地控制特定种类神经元的活动。光遗传学在时间上的精确度可达到毫秒级别,在空间上的精确度则能达到单个细胞级别。2010年,光遗传学被Nature Methods选为年度方法,同年被Science认为是近十年来的突破之一。这项技术目前在神经科学领域应用非常广泛,未来可能会应用于多种神经和精神疾病的治疗,如帕金森氏病、阿尔茨海默病、癫痫、脊髓损伤、精神分裂症等。
光遗传学技术基本原理
简单地说,光遗传学技术即借助遗传学手段,将能够对光起响应的通道蛋白表达在特定细胞中,实现通过光来激活或抑制神经元活动的目标。其中,激活或抑制的原理在于不同通道对阳离子或阴离子的通透:如果转入细胞的通道是ChR通道,那么在细胞接受蓝色激光照射时通道开放,阳离子内流,会产生去极化电位,诱发动作电位的发出,激活细胞;如果转入细胞的是HR一类通道的话,细胞接受黄色激光照射时阴离子内流,产生超极化电位,导致动作电位不易发放,抑制细胞活动;此外,还有一类光激活或抑制的通道optoXR,给光激活后其改变的是胞内激酶系统,影响细胞活动。因此,光遗传学技术的核心技术差异在于光敏感通道的选择。
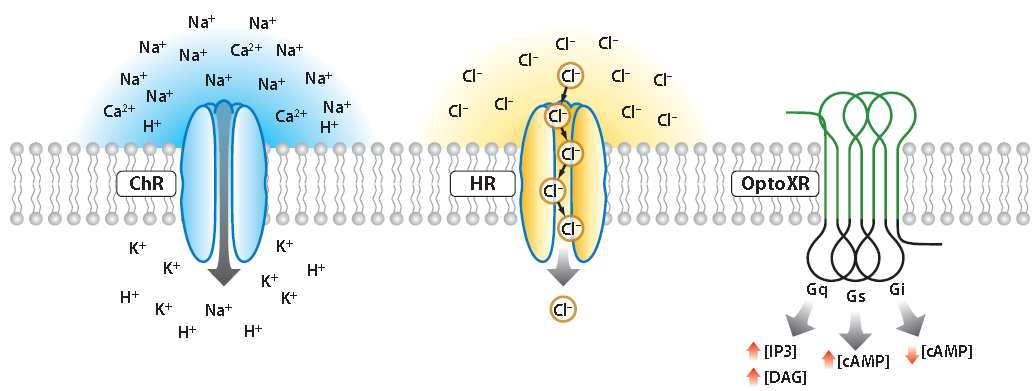
光遗传学的基本原理(Karl Deisseroth, et al., Annu. Rev. Biomed. Eng., 2014)
常见的光敏感通道
几种激活神经元的通道蛋白:
- ChR2(H134R):470nm蓝光激发。ChR2的突变体,该蛋白质可以产生两倍的光电流,但通道开关速度也比野生的ChR2慢了一倍。
- ChETA:470nm左右蓝光激发。ChR2的突变体,具有更快的动力学变化,某些神经元在激光刺激下可以发放200Hz的spike。
- oChIEF:450nm-470nm蓝光激发。在某些神经元中可以响应高频光(--100Hz)刺激,加速通道关闭的速度,在持续光照刺激下减少失活率。
- ChR2(C128S/D156A):ChR2的突变体,SFO光敏通道,用470nm激活通道,然后用590nm激光关闭通道,可以打开其离子通道长达30分钟。
- C1V1:540nm-560 nm激发。红移视蛋白,该通道蛋白类型更利于双光子激发。
- Chronos:500-530nm激发。高光敏度及快速开关动力学。
- ChrimsonR:590-600nm激发。做了K176R的点突变,增加了通道的关闭速度,适合用于刺激频率较高的场合。
- ST-ChroME:530nm左右激发,胞体定位,激活型ChroME通道。
- ChRger:470nm蓝光激发。相对无创(光纤放置在颅骨表面)。
几种抑制神经元活动的通道蛋白
- eNpHR3.0:589nm黄光激发。第一个有效抑制神经元活动的光遗传学工具,在黄绿激光照射下会将氯离子打进神经元内,而抑制神经元活动。当把NpHR表达在哺乳动物脑内时,会聚集在内质网上,因此,将内质网输出元件、高尔基体输出元件和来自于钾离子通道Kir2.1的上膜元件加在NpHR基因序列后面,这样就能实现在神经元细胞膜上的高量聚集,修改过的NpHR被称为eNpHR3.0,因此,eNpHR3.0 对细胞膜的靶向性较好,电流较为持久,响应时间短,反应灵敏。
- Arch:566nm左右激发。即为archaerhodopsin,是一种黄色激光激活的外向整流质子泵,能够将带正电的质子从神经元内移动到细胞外环境中,使神经元处于超极化状态。在特定条件下,可用于增加细胞内pH或减少细胞外基质pH。和NpHR相比,当激光关闭的时候,Arch立即从通道打开状态恢复到关闭状态。
- Mac:540nm激发。即为 Leptosphaeria maculans fungal opsins,是一种能够将带正电的质子从神经元内移动到细胞外环境中的质子泵,使神经元处于超极化状态。
- Jaws:632nm激发,红移视蛋白,红光照射下会使氯离子内流,从而抑制神经元活动。
- ST-eGtACR1:515nm激发。GtACR是一个Cl-通道,效率比NpHR、Arch等离子泵高很多,快速抑制。适合照光时间特别短、行为效应特别短的情况。ST-eGtACR1为其胞体定位版本。

常见光敏感通道特性(Karl Deisseroth’s, Nat Methods,2012)
和元生物拥有多种光遗传现货病毒库,欢迎咨询。
光遗传学技术的应用策略
借助病毒载体的光遗传学技术应用一般包括以下几个关键步骤:
1、 根据实验需求寻找合适的光敏蛋白;
2、通过病毒载体感染细胞,将光敏感通道表达在靶细胞中;
3、手术手段向脑中导入光纤,通过控制激光来实现对神经元活动的精准控制;
4、选择合适的病毒表达时间,结合行为实验设置合理的试验方案;
5、行为学手段或电生理手段验证。

光遗传学技术的一般策略(Karl Deisseroth, Scientific American, 2010)
光遗传学技术在啮齿类动物中的应用案例
ChR2(H134R)& eNpHR3.0
客户发表文章:Science. (IF=41.058). Mu D,et.al. (2017). A central neural circuit for itch sensation. [腺相关病毒, 痒, 光遗传,化学遗传]
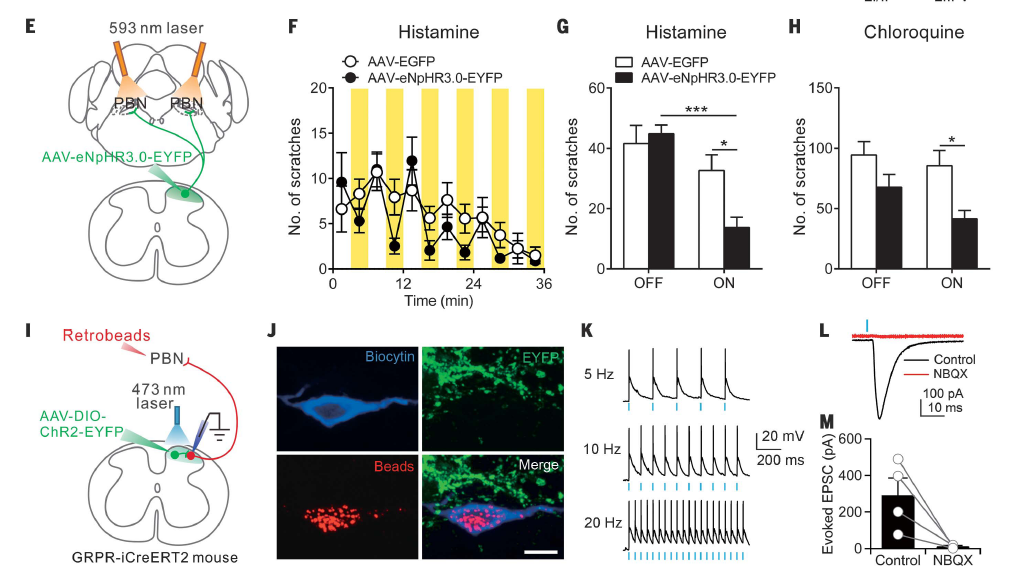
Yan-Gang Sun’s lab. Science 2017[1]
注射部位:小鼠脊髓
载体:AAV-EF1a-DIO-ChR2(H134R)-mCherry& AAV-hSyn-eNpHR3.0-EYFP
血清型:rAAV2/9
病毒滴度:5.1× 1012 VG/mL&1.7× 1013 VG/mL
注射体积:400-600nl


Zhong Chen’s lab. Nat Commun, 2020[2]
注射部位:PV-Cre小鼠的SNr区
载体:PV-Cre: AAV-EF1a-DIO-ChR2(H134R)-mCherry & AAV-CAG-FLEX-ArchT-GFP
病毒滴度:1.7× 1013 VG/mL&1.3× 1012 VG/mL
注射体积:200nl
光遗传学非人灵长类(NHP)实验数据资源库
光遗传学技术的出来可以帮助科研人员更深入的理解大脑与行为之间的神经机制,目前关于光遗传学的应用主要集中在啮齿类小动物模型,为了最大限度的发挥光遗传学的潜力,使其成为研究人类认知和行为的重要工具,然而,在这项技术应用于人类之前,谨慎的做法是先在非人类灵长类动物(non-human primates, NHPs)身上证明其安全性和有效性。NHPs的解剖学、生理学、遗传学和行为学特征比任何其他动物模型更接近人类。NHP与人类之间的同源性使其成为理解人类大脑功能和障碍的最佳实验模型。利用光遗传学从NHPs的细胞水平、环路水平及大脑网络层面去解析神经机制,有望揭示人类大脑功能和障碍的基本机制。
然而,在非人灵长类动物上使用光遗传学存在不少技术障碍,比如对于病毒载体、启动子和视蛋白的选择,以及注射剂量等等。由于啮齿动物和NHP之间的解剖学和遗传学差异,意味着那些在啮齿动物中使用的光遗传学策略在NHP中并不总是有效,对于想要开展NHPs光遗传学实验的研究人员来说,实验的操作指南很少。
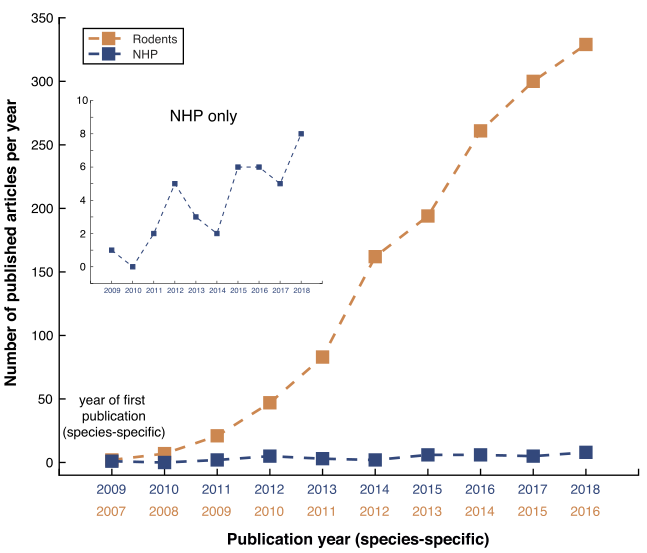
使用光遗传学技术发表的文章数
基于此,2020年10月19日宾夕法尼亚大学Sébastien Tremblay在《Neuron》在线发表题为An Open Resource for Non-human Primate Optogenetics的文章[3],综述了光遗传在非人灵长类动物模型中的最新进展,该文章总结了世界各地45个实验室,1000多个注射实验的方法和结果(包括未发表的数据),整合成光遗传学非人灵长类动物实验数据资源库,以帮助扩大光遗传学在NHPs中的应用。

该数据库包含6种不同品系的NHP,其中大部分实验在恒河猴(71%)上进行;使用最多的病毒载体为AAV2/5型(36%),其次是AAV2/9型(13%);使用最广泛的启动子为CaMKIIa(37%,特异性标记投射神经元),其次为hSyn(22%,特异性标记成熟神经元)和CAG(11%,广谱表达启动子)。 此外,在NHP中应用最广泛的报告基因为EYFP(45%),其次为GFP(17%)和mCherry(13%)。
同时,该数据库还分析了在NHP中最常用的到光遗传视蛋白:约39%使用激活型视蛋白--hChR2(H134R)、约25%使用抑制型视蛋白,这其中包括6%的ArchT、6%的Jaws。
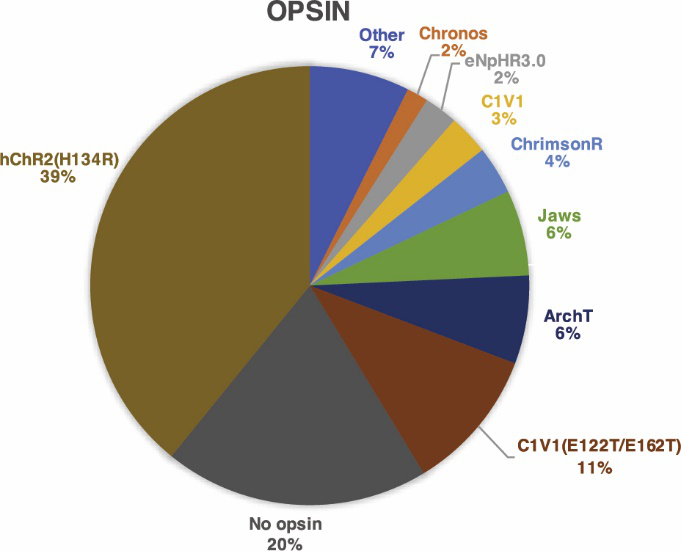
随后,研究人员通过解剖学、生理学、行为学手段来评估光遗传学实验在NHPs中的成功率:
发现,在食蟹猴(88%)的成功率最高,而AAV2/9和AAV2/8M(Y733F) 的成功率最高,分别为93%和88%,此外,对启动子分析发现,用CMV和CaMKIIa进行NHPs光遗传学实验的成功率最高,分别为85%和84%。
在视蛋白方面,eNpHR3.0的成功率最高,为88%;C1V1(T/T),其成功率约为86%,hChR2(H134R),在397次的注射实验中,产生了85%的成功率。
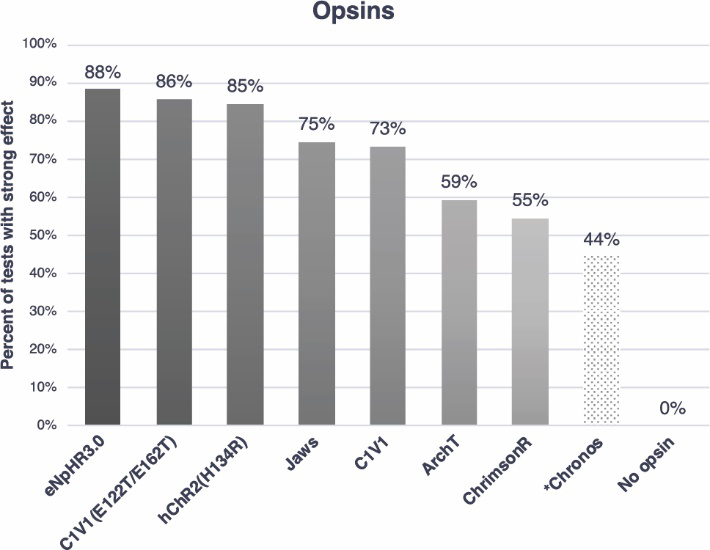
一般认为,较慢的注射速度可以减少对脑组织的创伤,此外,由于NHPs脑相较于啮齿类动物脑更大更复杂,病毒载体的注射体积也会影响实验效果。
从该数据库中分析了注射速率从6 nL/min到5000 nL/min的成功实验,多数集中在200 nL/min。注射体积多数为1-3uL。
光遗传学技术优势
-
时间精确度高:光遗传技术可以通过控制激光使时间精准度到毫秒级别甚至是亚毫秒级;
-
刺激的强度精确性高:光遗传技术通过控制激光,可以精准地、随时地调节给神经元刺激的强度,这对于某些刺激强度依赖的神经环路研究有不可替代的优势;
-
空间特异性:光遗传学技术可以通过脑定位注射、特异性启动子、甚至是亚细胞器定位肽,将光敏感蛋白锚定在靶向细胞或细胞器进行操作,可达到单个细胞的级别,实现精准定位;
-
作用工具多样:目前人们已经突变了一系列新的光敏感通道,这些通道的时间特性和激发光要求都不同,可根据具体的实验需求进行选择;
-
作用直接:不像DREADDs技术依赖于动物代谢水平,光遗传学技术通过激光操控细胞的激活或抑制,作用直接。
参考文献
[1] Science. 2017 Aug 18;357(6352):695-699. doi: 10.1126/science.aaf4918.
[2] Nat Commun. 2020 Feb 17;11(1):923. doi: 10.1038/s41467-020-14648-8.
[3] Neuron. 2020 Oct 12;S0896-6273(20)30751-0. doi: 10.1016/j.neuron.2020.09.027.