用 CD3/CD28 做好 T 细胞激活与扩增
德国IBA Lifesciences
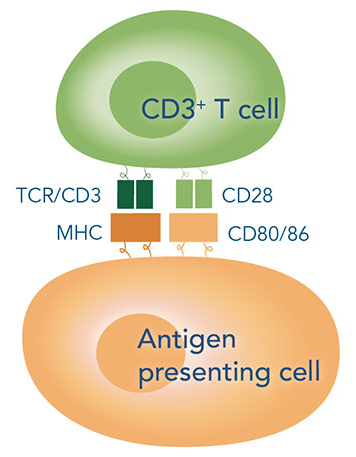
机体免疫应答过程的复杂性和严格的调控性,是由多种免疫细胞和免疫分子共同参与完成的。而T淋巴细胞的活化,在免疫应答中扮演着相当重要的角色。研究表明,诱导T细胞的活化与增殖需要两种信号:一种是 TCR/CD3 与抗原提呈细胞(APCs)表面特异的 MHCⅡ 抗原肽复合物结合产生的特异性抗原刺激信号;另一种是非特异性协同刺激信号,由 APCs 表面的协同刺激分子和 T 细胞的相应受体相互作用后产生,其中 CD28/B7 是最为重要的协同刺激分子,能增加 IL-2 的产生,加速T细胞增殖,阻止细胞进入无反应状态或死亡。
在体外联合使用 CD3 和 CD28 的抗体刺激 T 细胞,模拟 T 细胞活化的双信号作用,是进行 T 细胞激活与扩增应用最广泛的方法。除直接使用功能学抗体以外,目前磁珠法(CD3/CD28 抗体偶联磁珠)以及多聚体法(CD3/CD28 抗体偶联 Streptamer 多聚体)也是激活扩增 T 细胞比较常见的两种方法。以上说到的无论是抗体法、磁珠法、亦或者是多聚体法,归根结底都是借助于 CD3 与 CD28 抗体对 T 细胞进行刺激。
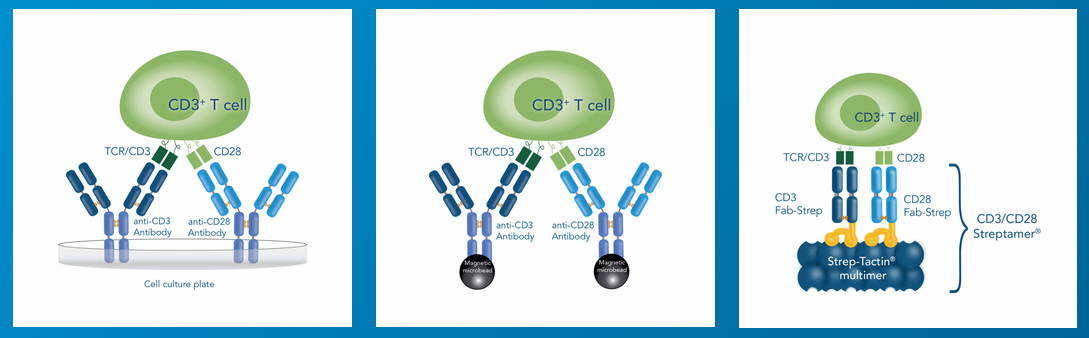
下面,我们以小鼠脾脏样本为例,分享分别利用 CD3 与 CD28 的功能学抗体,以及 CD3/CD28 Streptamer® 激活扩增 T 细胞的实验步骤与实验结果。
CD3/CD28抗体法
1、实验步骤:
1.1 抗体包被
用无菌 PBS 将 anti-mouse CD3 抗体(克隆号:145-2C11)稀释至 5μg/ml,稀释后的抗体加入到 24 孔板中,每孔 400μl,4°C 包被过夜。(注:板子在加入抗体之前,先用无菌 PBS 润洗 2-3 遍,避免干孔);
1.2 小鼠脾脏淋巴细胞分离(次日)
1. 将 70μm 细胞筛网置于培养皿中,取小鼠脾脏放置于筛网中,加入 5ml 达优小鼠淋巴细胞分离液,对脾脏轻轻进行研磨(注:此步操作要快,避免分离液蒸发);
2. 把悬有脾脏细胞的的分离液立即转移至 15ml 离心管中,随后在分离液上层轻轻覆盖 500-1000μl 的 RPMI1640 培养基(保持分离液与培养基分界明显);
3. 室温,水平转子 800g 离心 30 分钟,设置离心机为缓升缓降;
4. 离心结束后吸出淋巴细胞层(白膜层),加入 10ml RPMI1640 洗涤一遍细胞,250g 离心 10 分钟收集细胞;
5. 将上一步离心得到的细胞沉淀,重悬至扩增培养基中,并进行计数。
1.3 细胞刺激(次日)
扩增培养基成分:RPMI1640 + 10% 血清 + 5ug/ml anti-mouse CD28(克隆号:37.51) + 双抗
1. 将细胞浓度调整至 1-2×10^6/ml(本次实验为 2×10^6/ml,该浓度偏大);
2. 从 4°C 冰箱取出前一天包被的板子,弃掉包被液,无菌PBS洗涤3遍;
3. 每孔加入 500μl 细胞悬液,放置于 37°C 含 5% CO2 细胞培养箱中培养。
2、实验结果
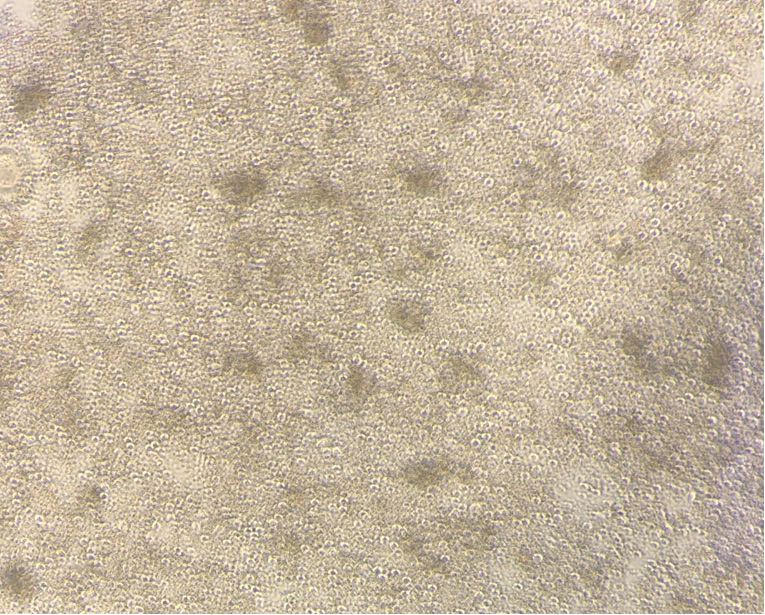
图:1×10^6/孔细胞,5μg anti-mouse CD3与CD28刺激3天后细胞形成明显克隆团
CD3/CD28 Streptamer® 多聚体法
1、实验原理
使用低亲和力的抗 CD3 和抗CD28的抗体 Fab 片段(非传统全长抗体),结合上 Twin-Strep-tag 亲和标签,形成 CD3 Fab-Strep 和 CD28 Fab-Strep。再结合可溶性蛋白多聚体 Strep-Tactin®,在亲和力作用下,即可与 TCR 和 CD28 共刺激受体多价结合,来传递激活信号。该方法最大的优势是在刺激过程中,能够通过加入 biotin 移除刺激试剂,达到精确掌控活化时间的目的。
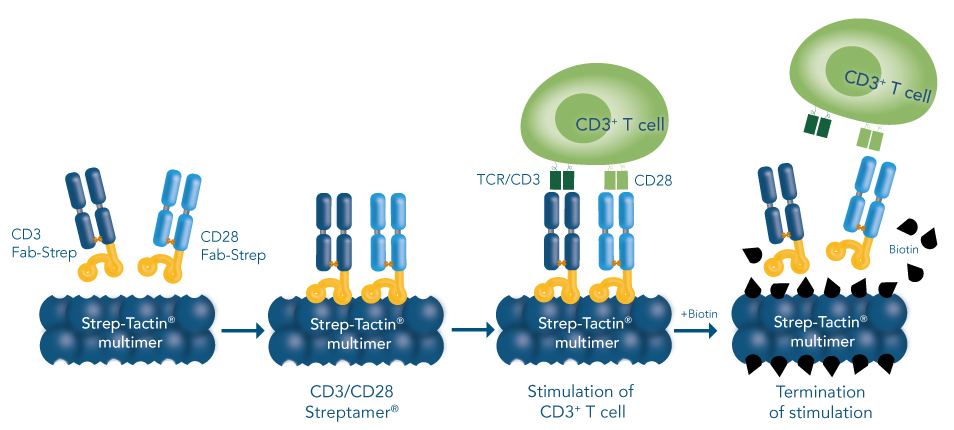
2、实验步骤
小鼠脾脏淋巴细胞的分离与上面抗体法中步骤相同,当然,也可以选择用分选试剂盒进一步分选得到 T 淋巴细胞进行刺激。(注:如果选择提前富集T淋巴细胞,建议使用阴选试剂盒或可以去除分选试剂的阳选试剂盒)
2. 用培养基(成分:RPMI1640 + 10% 血清 + 50U/ml IL-2 )调整细胞浓度至 5×10^5/ml,将步骤(1)中制备好的 CD3/CD28 Streptamer® complexes 与细胞悬液进行混合,轻轻吹匀后,将细胞加入到细胞培养板中,放置于 37°C 含 5% CO2 细胞培养箱中培养。细胞数量、培养基体积、多聚体用量配比参考以下表格:
| 培养板 | 96 孔板 | 48 孔板 | 24 孔板 |
| T 细胞数量 | 5-8×10^4 | 2-5×10^4 | 0.5-1×10^6 |
| 培养基体积(ml) | 0.1-0.2 | 0.5-1 | 1-2 |
| CD3/CD28 Streptamer premix(μl) | 3 | 15 | 30 |
3. 培养过程中,每天观察细胞的状态,是否形成克隆团,或进行细胞计数,如果出现培养基变黄或细胞密度过高的情况,吹散细胞克隆团后调整细胞密度至0.5-1×10^6/ml,更换培养板和培养基;
4. 移除 CD3/CD28 Streptamers 终止刺激(该步根据实验需求可选做):直接向刺激后的细胞悬液中加入终浓度为 1mM 的 Biotin,室温孵育 30 分钟。收集并转移细胞至 15ml 离心管中,加入 10ml 培养基,300g 离心 6-10 分钟,弃上清,再次加入 10ml 培养基重复一遍洗涤步骤,至此,细胞已经可以用于下游分析。
3、实验结果
以下实验结果是分选得到 T 淋巴细胞后进行的刺激,在此特别感谢德国 IBA Lifesciences 提供的内部实验数据以及详细实验步骤。

图:小鼠脾脏 T 淋巴细胞扩增至 3 天时,显微镜下观察细胞克隆团的形成

图:小鼠脾脏 T 淋巴细胞扩增过程中,通过流式细胞术实时检测 T 细胞激活 marker CD25、CD69 的表达变化情况
相关关键试剂
- CD3/CD28 抗体法:
| 货号 | 名称 | 厂家 |
| 7211011 | 小鼠淋巴细胞分离液 | 达优 |
| 100339 | Ultra-LEAF™ Purified anti-mouse CD3ε Antibody | BioLegend |
| 102115 | Ultra-LEAF™ Purified anti-mouse CD28 Antibody | BioLegend |
- CD3/CD28 Streptamer® 多聚体法:
| 货号 | 名称 | 厂家 |
| 6-3201-002 | CD3 Fab-TACS® Agarose column Starter Kit | IBA |
| 6-8920-050 | CD3/CD28 Streptamer® Kit, mouse | IBA |







