「神药」再显威!杨黄浩等让二甲双胍扮演 PD-L1 「单抗」角色,提高治疗效果
丁香学术
450
以 PD-1/PD-L1 为代表的免疫检查点抑制剂(Immune Checkpoint Blockades, ICBs)在实体瘤中「大杀四方」,取得了传统治疗方法未有的良好疗效,逐渐成为了继手术、放疗、化疗、靶向治疗后又一种重要的肿瘤治疗手段。
然而,免疫检查点抑制剂在实体瘤中的总体有效率依然仅有 20-30%。目前的 PD-1/PD-L1 等抗体类药物治疗依然存在着一些不可避免的问题, 如致命的免疫相关不良事件 (irAE)、复杂的生产工艺、高昂的成本等。此外,基于抗体的 ICBs 通过构象封闭肿瘤细胞表面的 PD-L1 而达到治疗效果。这种阻断作用是暂时的,可能由于细胞内 PD-L1 主动重新分布到细胞膜而减弱,导致治疗效果受损。
福州大学的杨黄浩团队将二甲双胍「老药新用」,研制出了一种自组装的纳米片(MS NPs)。该纳米片是由二甲双胍 Met(作为一种免疫佐剂)和抗癌药物 SN38(即 7 - 乙基 - 10 - 羟基喜树碱,作为一种 DNA 拓扑异构酶 I 抑制剂)组装而成。其作用机制不同于传统的抗体类 ICBs,这种纳米片主要是干扰内源性的 PD-L1 表达,进而达到了类似 ICBs 的抗肿瘤效果。
该研究成果以 Reducing PD-L1 expression with a self-assembled nanodrug: an alternative to PD-L1 antibody for enhanced chemo-immunotherapy. 为题,发表在了 2021 年 1 月 1 日的 Theranostics 上 [1]。

图片来源:Theranostics
研究内容:
此前有研究报道,二甲双胍可以抑制肿瘤进展,改善癌症患者的预后和生存率。此外,也有研究显示,Met 可以诱导 PD-L1 糖基化异常,导致内质网介导的 PD-L1 降解,从而促进抗肿瘤免疫。这些发现表明,二甲双胍的新用途可能会为解决免疫检查点治疗的困境带来一线曙光。
为了寻找新的治疗药物,解决抗体类 ICBs 因 PD-L1 重分布而导致疗效受损的问题,研究团队研制了一种新型的纳米片。研究团队将二甲双胍 Met 与化疗药物 SN38 通过氢键和静电相互作用自组装成纳米片自组装成纳米片(MS NPs)。
将该纳米片递送到肿瘤组织后,化疗药物 SN38 可以直接介导细胞毒作用,杀死部分癌细胞,释放大量肿瘤裂解物(包括肿瘤抗原),召募免疫细胞浸润到肿瘤组织中;同时,二甲双胍可以诱导 PD-L1 的糖基化异常,促进内质网介导的 PD-L1 降解,降低内源性 PD-L1 的表达,促进浸润的免疫细胞的杀伤活性。
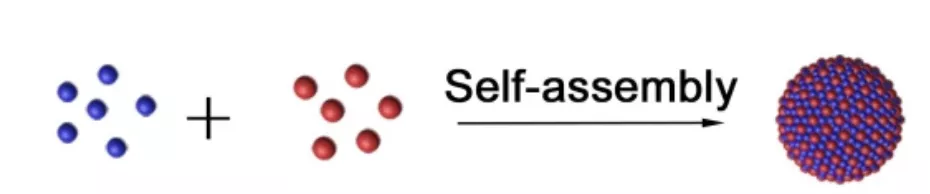

图片来源:Theranostics
为了验证这种纳米片的效果和可行性,研究团队首先进行了一系列体外实验。
研究团队用制备的纳米片 MS NPs 处理肿瘤细胞 MB231,随后从细胞总 PD-L1 表达量(Western Blot)、细胞表面 PD-L1 水平(流式细胞分析)、PD-L1 定位(荧光共定位)等不同的角度进行分析,验证了纳米片 MS NPs 可以介导内源性的 PD-L1 表达降低。
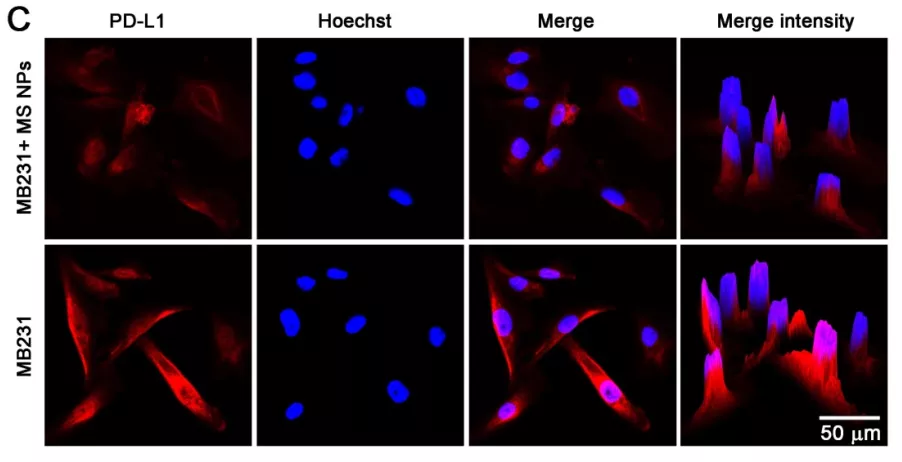
图片来源:Theranostics
是骡是马,得拿出来遛一遛。研究团队又将纳米片 MS NPs 用于治疗 4T1 荷瘤小鼠,同时设置了不同的对照组:生理盐水组、PD-L1 抗体治疗组、二甲双胍 Met 组、单纯化疗 SN38 组、Met/SN38 序贯治疗组。结果发现,与对照组小鼠相比, MS NPs 组的小鼠肿瘤生长被显著抑制,小鼠的生存时间显著延长。
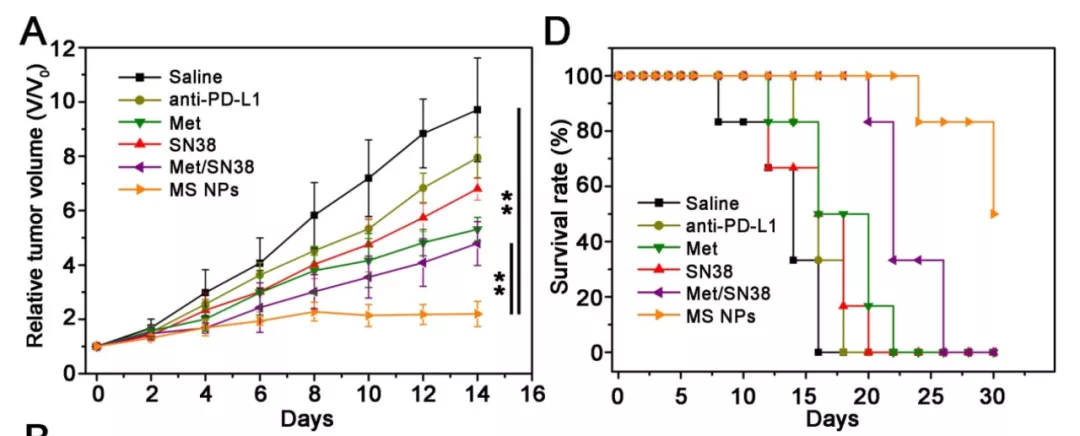
图片来源:Theranostics
同时,研究团队还发现,纳米片 MS NPs 不仅可以显著抑制肿瘤的生长,还可以显著抑制肿瘤的转移。
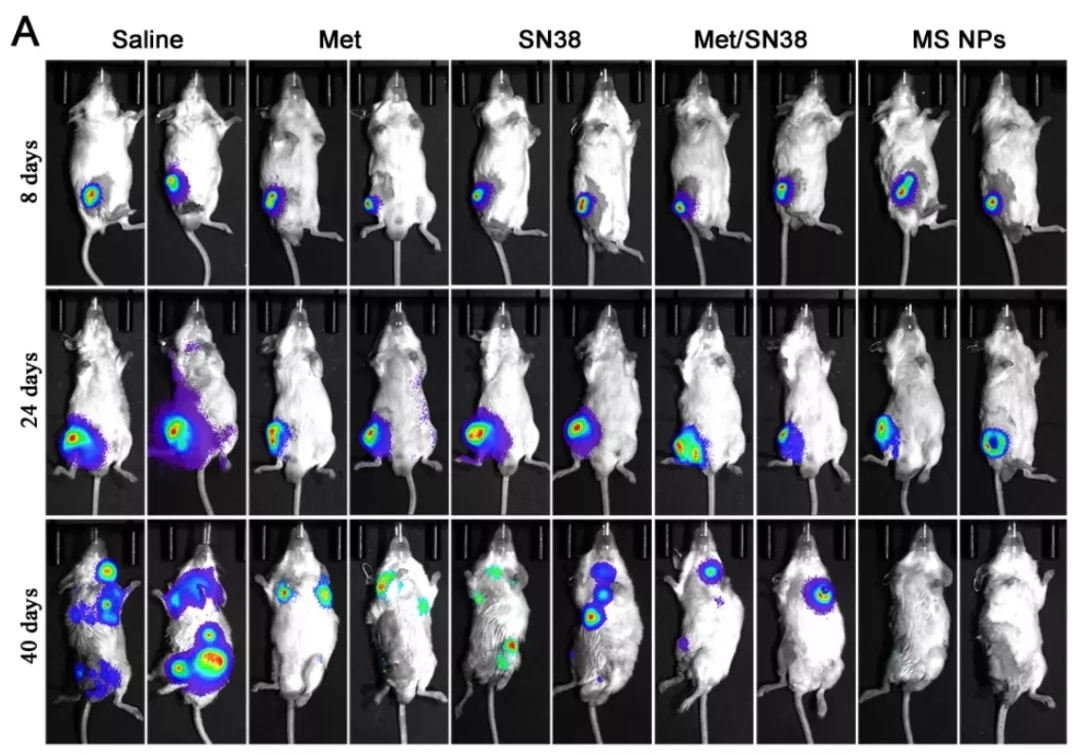
图片来源:Theranostics
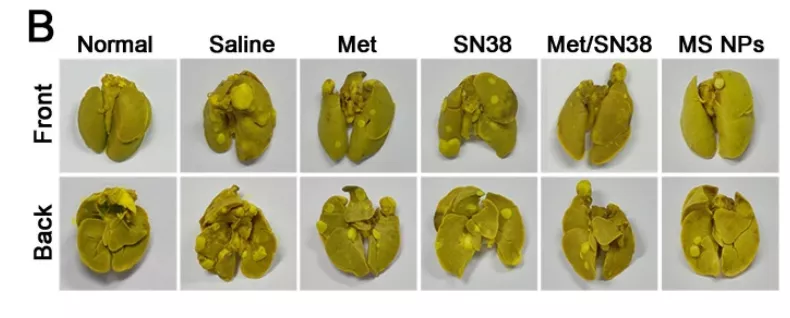
图片来源:Theranostics
最后,为了探究纳米片 MS NPs 的安全性,研究团队给予小鼠静脉注射 MS NPs (24 mg/kg),采用血常规和血液化学方法评价 MS NPs 的潜在体内毒性。
结果显示,MS NPs 处理组小鼠与生理盐水处理组比较,血常规各项指标均在正常范围内。血液中的重要肝功能指标,包括丙氨酸氨基转移酶 (ALT)、天冬氨酸转氨酶 (AST) 和碱性磷酸酶 (ALP) 的水平似乎也是正常的。血液中的尿素水平 (肾功能的指标) 也在参考范围内。因此,治疗剂量的 MS NPs 是安全的。
研究意义:
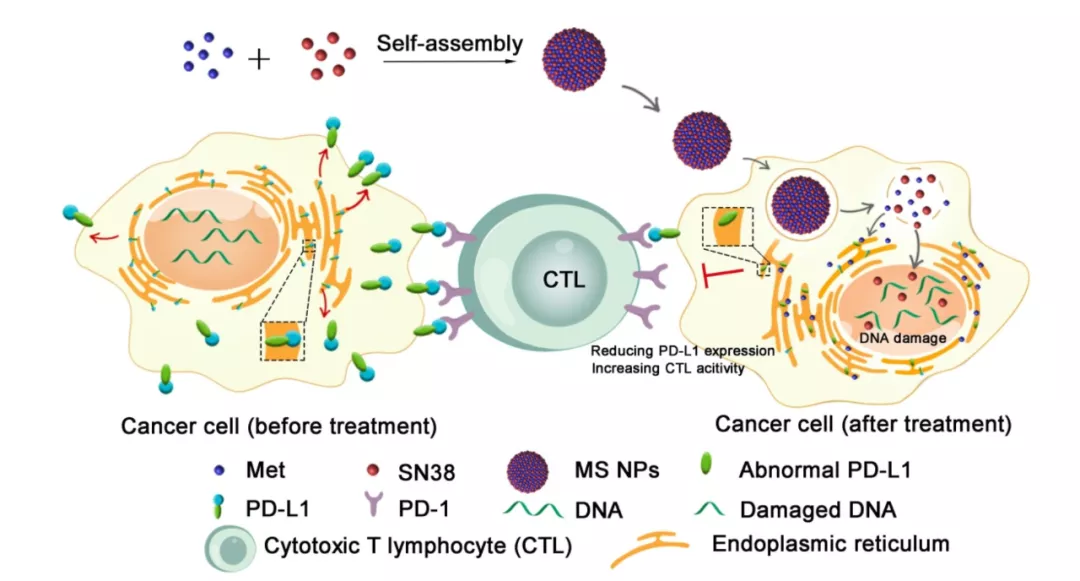
图片来源:Theranostics
研究团队通过免疫佐剂 Met 和抗癌剂 SN38 的自组装研制了一种新型纳米制剂 ——MS NPs,用于联合免疫治疗和化疗。
MS NPs 通过重塑细胞外基质和恢复免疫监视,不仅有效地抑制了肿瘤的生长,而且显著抑制了肿瘤转移,延长了小鼠的生存时间。
更重要的是,与传统的抗体类 ICBs 通过构象阻断细胞表面 PD-L1 的作用机制不同,Met 的引入赋予 MS NPs 降低癌细胞内源性 PD-L1 表达的能力,从而有效地唤醒宿主的免疫系统。
这种新型的纳米片 MS NPs 可能可以克服基于抗体的 ICBs 的缺点,对老药二甲双胍的再利用可能会为新型 ICBs 的开发提供新的见解。
延伸阅读:
1、 二甲双胍降低 PD-L1 表达的具体机制
杨黄浩团队的研究成果主要是应用转化,为临床治疗实体瘤提供了新的治疗思路。然而,二甲双胍到底如何降低 PD-L1 的表达,在本文中并没有展开详细研究。
其实早在 2018 年,美国学者 Mien-Chie Hung 团队发现 [2],长期服用二甲双胍的乳腺癌患者,其肿瘤组织的 PD-L1 表达水平较低。
进一步深入研究后发现,二甲双胍直接激活了 AMPK,后者直接介导了 PD-L1 中 S195 的磷酸化。S195 磷酸化导致 PD-L1 糖基化异常,异常的 PD-L1 通过内质网相关蛋白降解(ERAD)途径降解,降低了 PD-L1 的表达水平。二甲双胍阻断 PD-1/PD-L1 信号轴可增强 CTL 对癌细胞的杀伤活性。
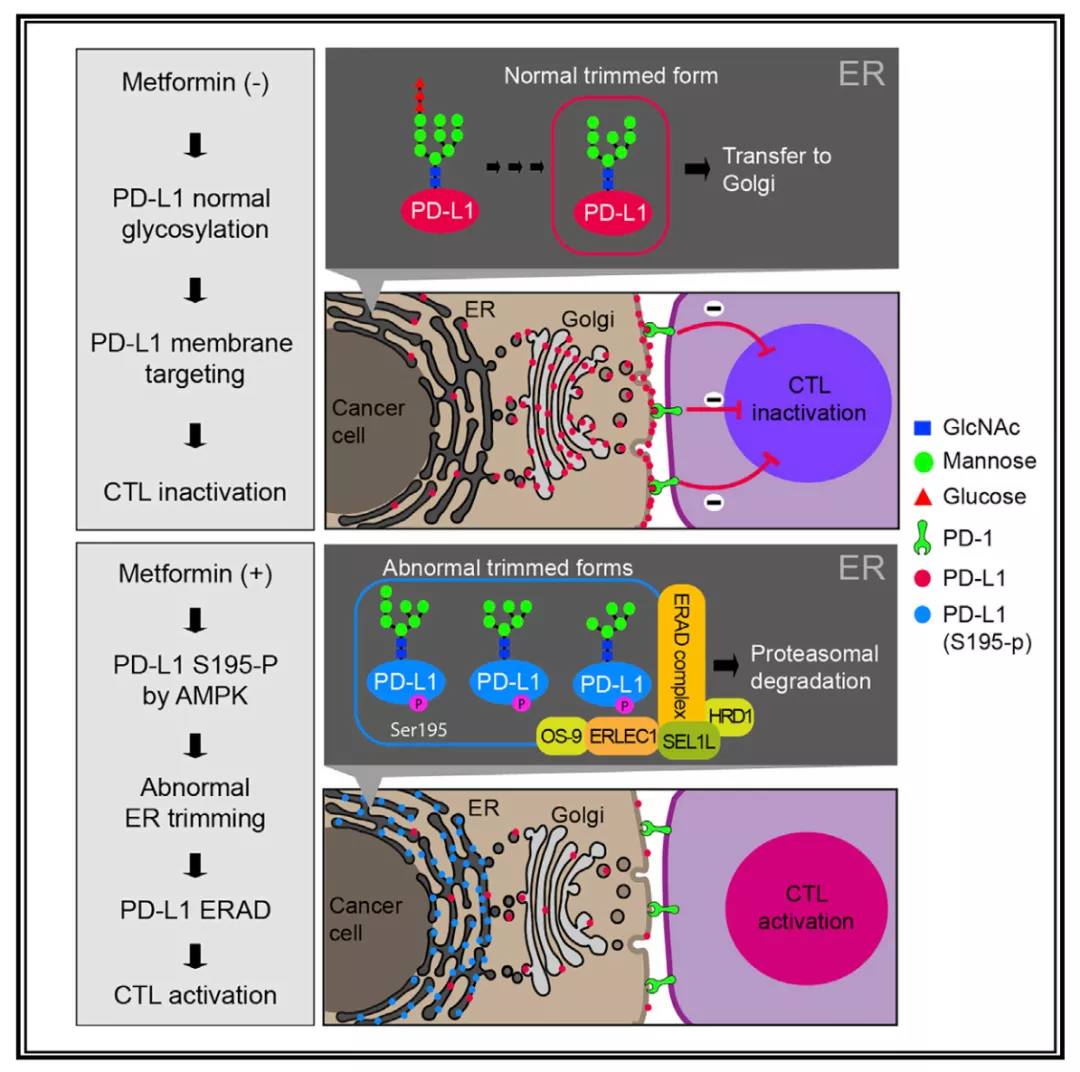
图片来源:Molecular Cell
2、 二甲双胍的「星星之火」,在肿瘤免疫中「可以燎原」
随着免疫治疗在肿瘤治疗中的作用和地位越来越重要,对于肿瘤微环境的免疫状态越来越受到重视。目前认为,「热肿瘤」(肿瘤组织中有更多的免疫细胞,如 APC、TIL 等细胞的浸润)对肿瘤免疫治疗的反应好,反之,「冷肿瘤」(肿瘤组织中几乎没有免疫细胞的浸润)的反应差。如何将「冷肿瘤」转化为「热肿瘤」成为了目前研究的热点。
二甲双胍已经被发现具有抗炎、抗缺氧作用,对衰竭 T 细胞的代谢重编程起作用,并对肠道微生物群产生有利作用。此外,在多种动物模型中观察到二甲双胍具有积极的抗肿瘤免疫作用。
这些发现提示我们,二甲双胍很有潜力成为一种免疫佐剂,这一「星星之火」可以通过重塑肿瘤微环境生态,逆转肿瘤的免疫抑制状态,在抗肿瘤免疫应答中全面「燎原」。
已经有二甲双胍和免疫检查点抑制剂(ICB)联合治疗的临床研究正在开展中,期待老树开新花,为抗肿瘤免疫应答不断「升温助燃」。
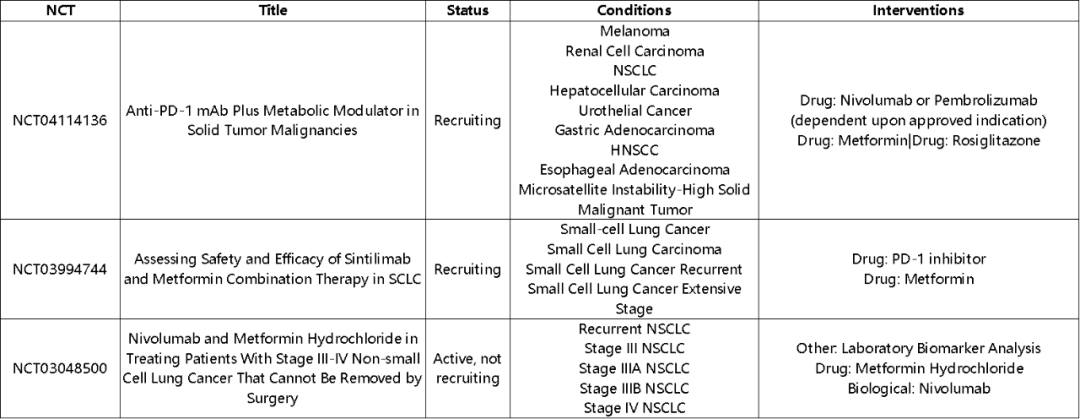
数据来源:https://www.clinicaltrials.gov
本周推荐:
三句话读懂一篇 CNS,首次揭示从鱼进化到人的演变机制,运动能帮助人体对抗慢性炎症...
两院院士评选 2020 年中国、世界十大科技进展揭晓
中科院高福院士课题组 2020 年研究成果盘点
Cell Metab:延寿新点子,多吃脂肪活的久?哈尔滨医科大学孙长颢 / 李颖 / 牛玉存报道等热量的中等高脂饮食可延长寿命
盘点 2020 年中国学者的十大免疫学研究成果,有的已经被写进高考题?!
挑战传统认识:肝硬化不是肝癌的发病诱因,而是保护因素?Cell:发表专家观点
[1] Cai S etal. Reducing PD-L1 expression with a self-assembled nanodrug: an alternative to PD-L1 antibody for enhanced chemo-immunotherapy. Theranostics, 2021. DOI: 10.7150/thno.45777
[2] Jong-Ho Cha, etal. Metformin Promotes Antitumor Immunity via Endoplasmic-Reticulum-Associated Degradation of PD-L1. Molecular Cell, 2018. DOI: 10.1016/j.molcel.2018.07.030



![二甲双呱盐酸盐[1115-70-4]](https://img1.dxycdn.com/p/s14/2024/0922/556/2382746517108787381.jpg!wh200)



