Nature 重磅:新发脑胶质瘤疫苗初见成效,瞄准肿瘤「阿喀琉斯之踵」
丁香学术
227
胶质瘤,顾名思义,是一种由神经胶质细胞恶化发展而来的中枢神经系统肿瘤,是目前发病率最高的原发性颅脑肿瘤。据美国脑肿瘤注册中心(Central Brain Tumor Registry of the United States,CBTRUS)统计,胶质瘤约占所有中枢神经系统肿瘤的四分之一,占所有颅脑恶性肿瘤的 80%。
胶质瘤具有侵袭性生长的特点,虽然手术治疗仍是首选,但难以根治,很容易复发。手术联合放疗及替莫唑胺为主的化疗是目前临床上主要的治疗方案,但是效果并不理想。
自 2008 年 Parsons DW 教授在胶质母细胞瘤中首次发现异柠檬酸脱氢酶-1(isocitrate dehydrogenase,IDH1)突变以来,IDH1 突变的影响及意义逐渐成为了脑胶质瘤的研究热点。许多科学家以 IDH1 为靶点,通过肿瘤疫苗、细胞疗法等免疫治疗方式,以期在脑胶质瘤的治疗中取得突破 [1]。
2021 年 3 月 24 日,来自德国海德堡的 Michael Platten 团队研制出了一种靶向 IDH1 突变的肿瘤疫苗(IDH-vac)。这种肿瘤疫苗可以在患者体内有效激活抗肿瘤免疫应答反应,发挥抗肿瘤效应。该成果以 A vaccine targeting mutant IDH1 in newly diagnosed glioma 为题发表在最新的 Nature 上 [2]。

图片来源:Nature
研究内容:
这是一项靶向 IDH1R132H 的多肽疫苗治疗 III-IV 级(WHO 分级)胶质瘤的安全性、耐受性和免疫原性的多中心 I 期临床研究(NCT02454634)。研究人员筛选了 44 名患者,其中 32 名患者入组参与了临床试验并接受了 IDH-vac 治疗。
在这 32 名患者中,男性 20 例 (62.5%),女性 12 例 (37.5%),平均年龄 (40.4±8.95) 岁。根据患者在入组前接受的标准治疗 (SOC),试验人群被分成三个治疗组 (TG1-TG3):单纯放疗 (RT,TG1),单独使用 TMZ 进行三个周期的化疗 (mono-TMZ,TG2) 或联合放化疗联合 TMZ (RT+cTMZ,TG3)。大多数患者在接种 IDH1 疫苗前同时接受放化疗和 TMZ 治疗 (n=23,71.9%),3 例 (9.4%) 接受 TMZ 治疗,6 例 (18.8%) 接受单纯放疗。
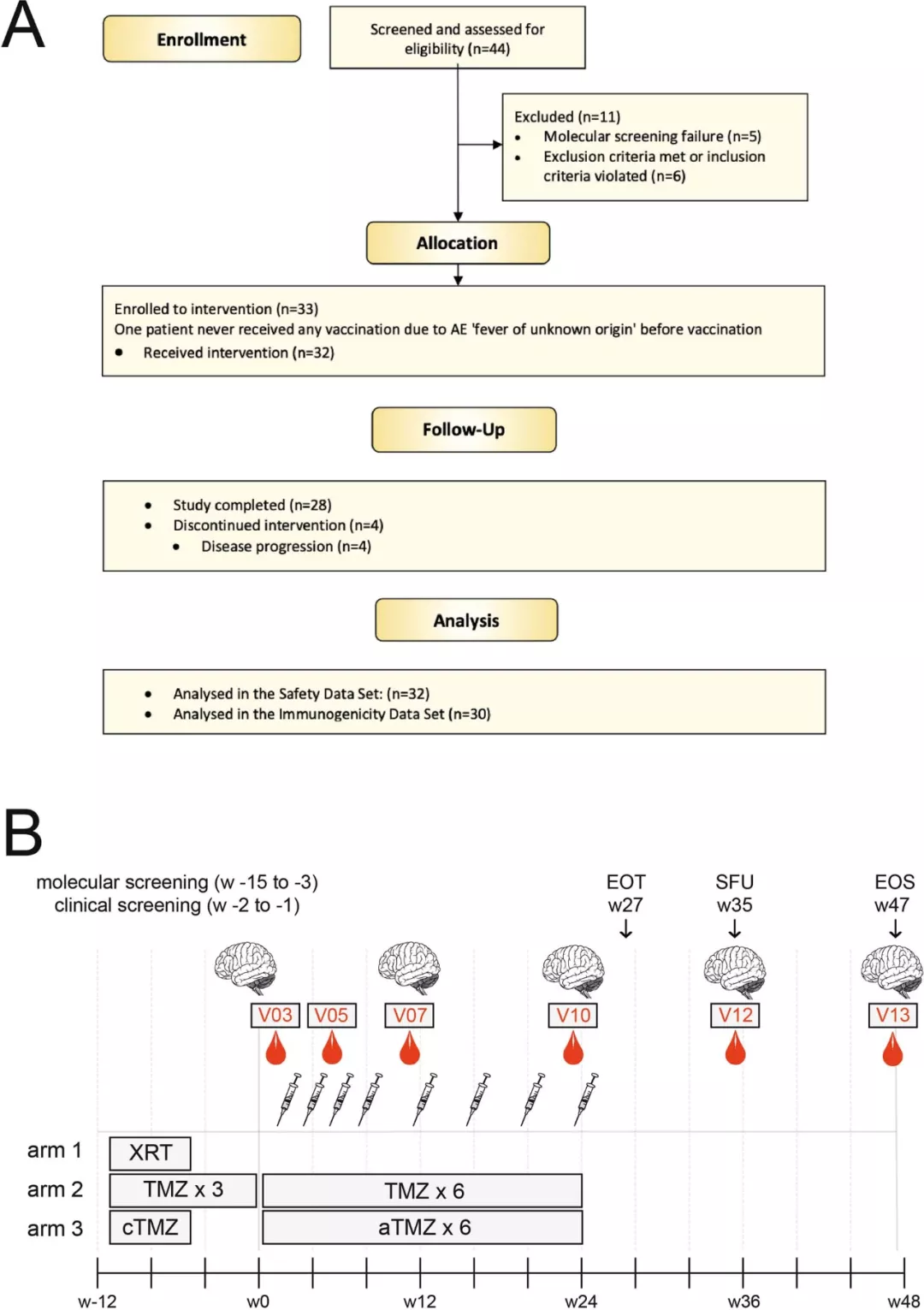
图片来源:Nature
研究人员给 32 名患者进行了 IDH1-vac 疫苗治疗,未观察到系统限制性毒性 (RLT)。32 名患者中有 29 名 (90.6%) 出现了与治疗相关的不良事件,均不严重。1 名患者 (3.1%) 发生了与治疗相关的严重不良事件,21 例患者发生了 IDH1-Vac 可能相关的不良事件,主要表现为注射部位硬化或红斑。
因此,IDH1-vac 疫苗是安全可耐受的。
在免疫原性分析集(IDS)的 30 名患者中,28 名 (93.3%) 表现出 IDH1-VAc 诱导的免疫应答。其中,26 名患者观察到 IDH1-vac 诱导的 T 细胞免疫反应,28 名患者观察到跨越多个人类白细胞抗原 (HLA) 等位基因的 B 细胞免疫反应。但是还有 2 名患者 (6.7%) 既没有出现 T 细胞免疫反应,也没有出现 B 细胞免疫反应。
因此,IDH1-vac 疫苗可以有效诱导机体产生 IDH1 特异性的免疫应答反应,提示新抗原 IDH1(R132H)具有良好的免疫原性。
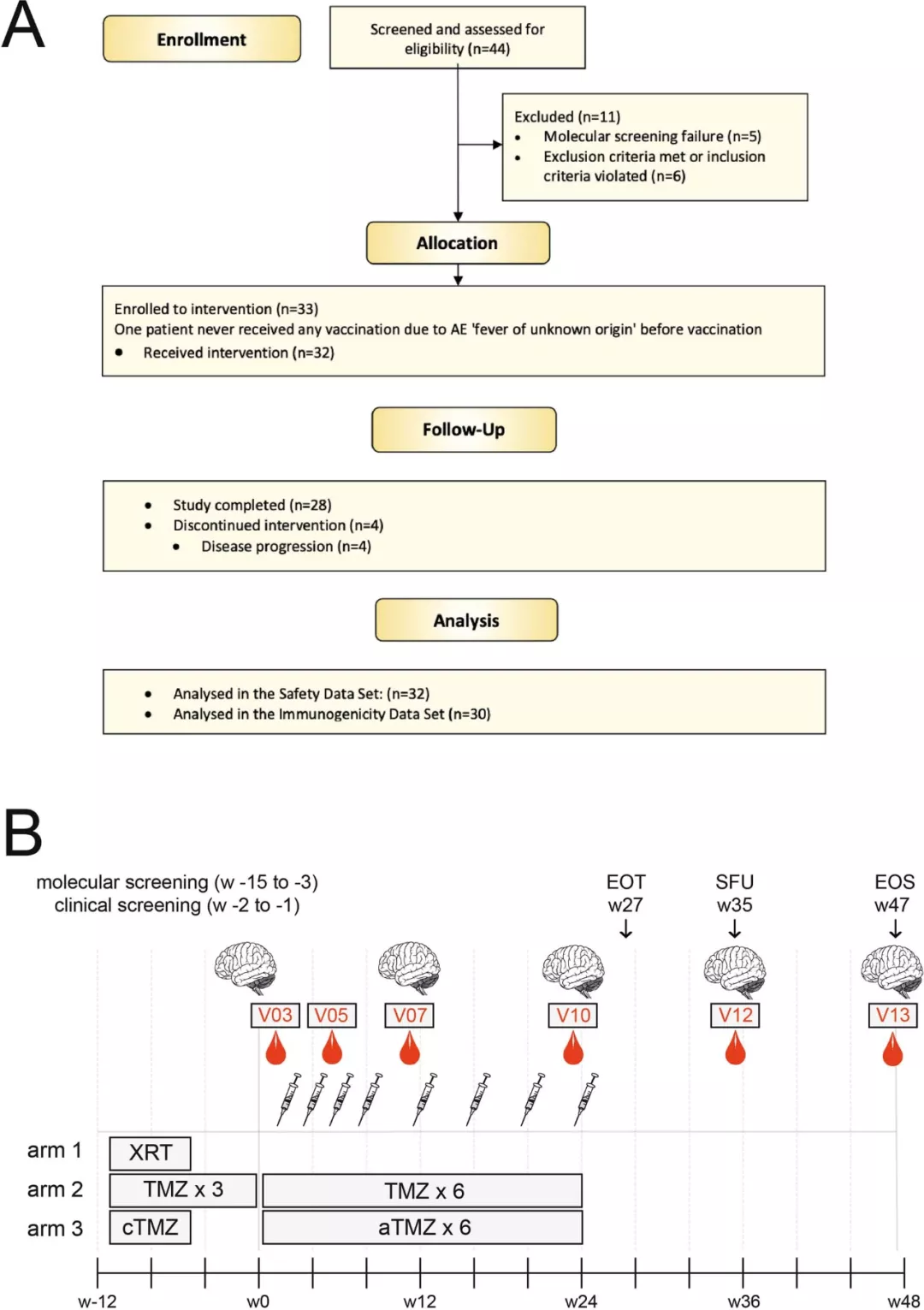
图片来源:Nature
在疗效方面,患者的总体反应率(overall response rate,ORR)为 84.4%(27/32 例)。在随访分析中,3 年 PFS 和 OS 比率分别为 63% 和 84%。接受了疫苗治疗但未出现免疫应答的 2 名患者在 2 年内出现了疾病进展,而有免疫应答组的 2 年 PFS 率为 82%。
因此,IDH-vac 疫苗可以显著延长患者的无疾病进展时间和生存时间。
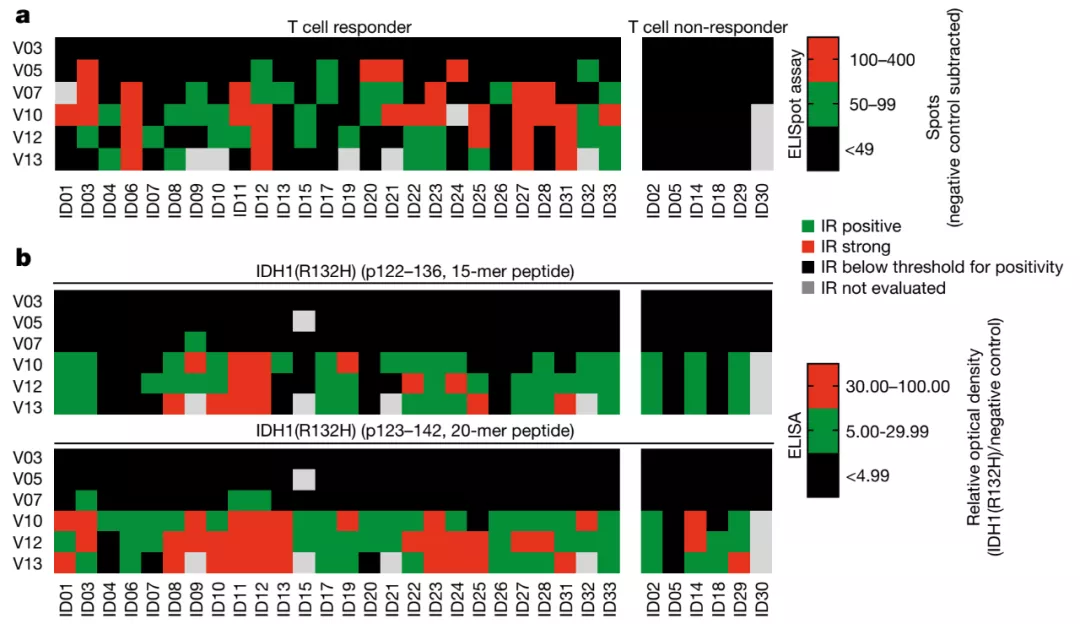
图片来源:Nature
值得一提的是,在临床试验期间,假进展是比较常见的一个现象。32 名接受疫苗治疗的患者中,有 12 名 (37.5%) 出现假进展 (PSPD)。脑成像结果提示,这些 PSPD 病灶内存在炎症反应,这可能与 IDH1-VAc 诱导的外周免疫反应的发生有关,并仅限于短暂或持续的 T 细胞免疫反应的患者;在无应答的患者中没有检测到 PSPD。
进一步研究分析发现,PSPD 与任何评估的肿瘤固有分子标志物无关,例如拷贝数变异负荷 (CNV-L)、甲基化类别、CDKN2A 或 CDKN2B 缺失状态、外周免疫细胞亚群的频率或外周 T 细胞克隆类型的改变等。12 名 PSPD 患者中有 7 名患者 (58.3%) 的肿瘤依然保持稳定,中位随访时间为 53.1 个月。
因此,肿瘤假进展可能是 IDH1-VAc 诱导的外周 T 细胞免疫应答反应所致,也可能预示着这类患者具有更好的预后。
图片来源:Nature
在所有出现 PSPD 的患者中,只有 ID08 患者接受了病灶切除。研究人员从切除的病灶中分离出浸润性白细胞(LILs)后通过体外 IFN-γ ELISPOT 实验分析后发现,这些 LILs 中存在 IDH1 (R132H) 反应性 T 细胞。进一步分析后发现,这些 IDH1 (R132H) 反应性 T 细胞可能是 CD4+T 细胞。
单细胞测序 (scRNA-seq) 结果显示,患者 ID08 的 PSPD 病灶中发现了三组 CD4+T 细胞:调节性 T 细胞、活化的 CD40LG+CD4+T 细胞和 CXCL13+CD4+T 细胞。有研究报道,CXCL13+CD4+T 细胞对抗肿瘤免疫很重要。再结合 TCR 测序结果,研究人员发现 CD40LG+CD4 + 和 CXCL13+CD4+T 细胞簇都由一个 TCR 控制,即 TCR14。TCR14 是 CD4 + 单个 T 细胞谱系中第四丰富的 TCR,而前三位丰富的 CD4+TCR (TCR11-13) 主要表达在调节性 T 细胞上。患者 ID08 在接受 IDH1-Vac 疫苗治疗后,其 PSPD 病灶中 TCR14 的含量是该患者外周血的 50.6 倍。
因此,这些结果表明 IDH1-Vac 疫苗可以诱导 IDH1 (R132H) 特异性 TH 细胞的克隆性增殖,并且这些细胞可以浸润到病灶中。
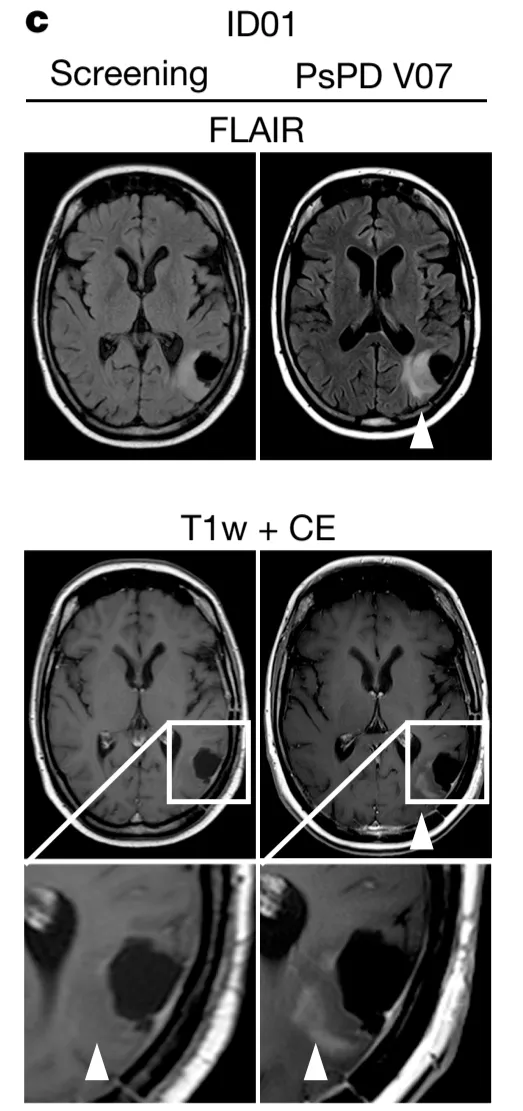
图片来源:Nature
研究意义:
虽然研究团队的 Michael Platten 教授说:「在没有对照组的情况下,我们不能从这项早期研究中得出任何关于疫苗效力的进一步结论。」但是,这项 I 期临床研究的结果已经初步证实了这种靶向新抗原 IDH1(R132H)的肿瘤治疗性疫苗的安全性、耐受性和有效性,提供了开发一种更有效、更长期地抑制这些肿瘤的治疗方法的潜力,给广大脑胶质瘤患者带了希望的曙光。在这项后续研究中,该团队将 IDH1-vac 疫苗与检查点抑制免疫疗法结合起来。
除此之外,这项研究也给了我们很多启示: