Cell Metab:西京医院王琳教授团队报道非酒精性脂肪肝炎新靶点
丁香学术
260
随着人们饮食和生活习惯的改变,非酒精性脂肪性肝病(NAFLD)已逐渐成为世界范围内最常见的慢性肝病 (1)。如果没有得到有效的治疗,NAFLD 可能发展为非酒精性脂肪性肝炎(NASH),这可能进一步导致一系列代谢紊乱甚至肝癌的发生 (2)。
尽管医疗需求迫切,但目前几乎没有药物获批用于 NASH 的治疗 (3)。因此,进一步探索 NASH 进展的分子机制,以确定潜在的治疗靶点显得至关重要。
2021 年 6 月 18 日,来自第四军医大学西京医院的王琳、窦科峰教授团队在 Cell Metabolism 上在线发表了题为 Tripartite motif 16 ameliorates nonalcoholic steatohepatitis by promoting the degradation of phospho-TAK1 的研究成果 (4)。该研究发现 E3 泛素连接酶 TRIM16 通过促进 p-TAK1 的泛素化依赖性降解,改善 NASH 进展过程中的脂质积累和炎症。

图片来源:Cell Metabolism
研究内容
肝细胞的脂肪毒性诱导 TRIM16 的表达
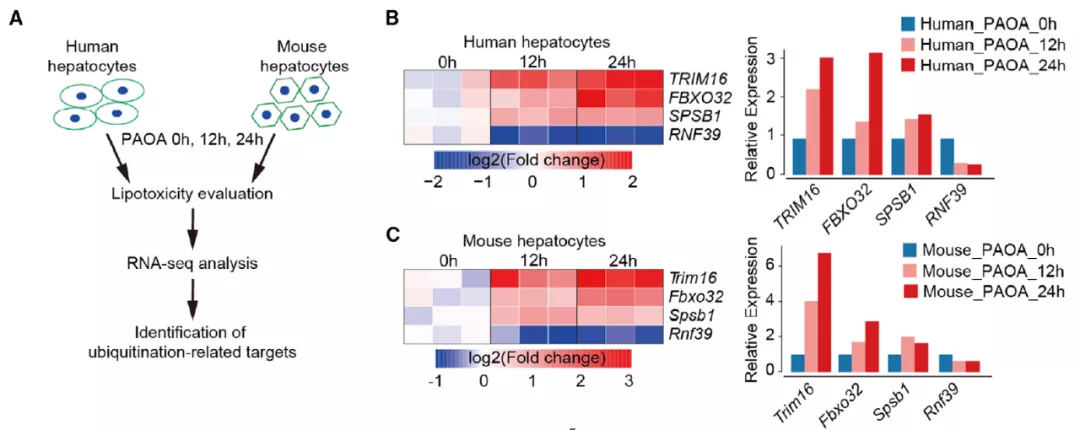
脂肪毒性是脂质过度积累的结果,在 NASH 进展中有着重要作用 (5)。在本研究中,作者主要希望关注这一过程中的泛素化相关分子。
作者首先用棕榈酸和油酸(PAOA)处理肝细胞,以建立一个脂肪毒性的细胞模型,并通过 RNA-seq 技术筛选差异表达的基因。作者筛选到了 4 种 E3 泛素连接酶,其中 TRIM16 的表达差异最为显著。细胞和动物实验也证实,TRIM16 会被脂肪毒性诱导表达。因此,作者选择 TRIM16 进行更加深入研究。
图片来源:Cell Metabolism
那么,TRIM16 在脂肪毒性中发挥了怎样的作用呢?作者在原代肝细胞中过表达 TRIM16,发现 PAOA 处理导致的脂质累积得到显著缓解。在小鼠模型中,特异性敲除肝细胞 TRIM16,会加重高脂饮食诱导的肝脂肪变性,并加剧高脂高胆固醇饮食诱导的 NASH 的发生。
TRIM16 抑制 NASH 中 JNK-p38 信号通路
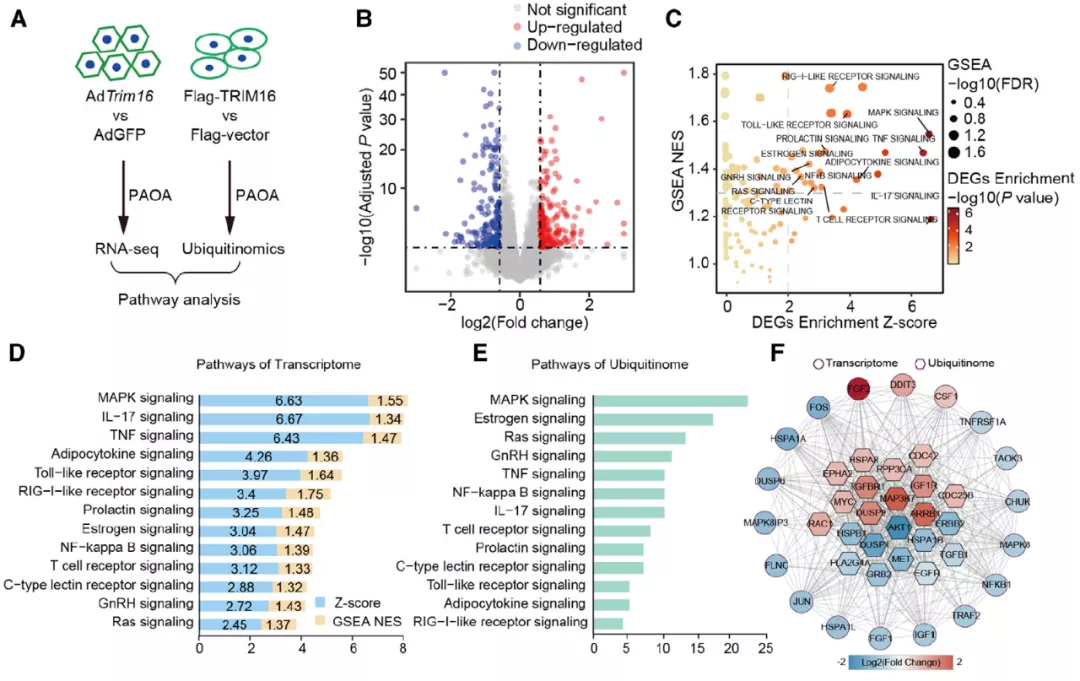
TRIM16 又是通过什么样的机制影响 NASH 的呢?考虑到 TRIM16 是一种 E3 泛素连接酶,作者进行了转录组学和泛素组学的联合分析,来探索 TRIM16 发挥功能的潜在通路和下游靶标。
对转录组数据进行富集分析发现,TRIM16 过表达显著调控了多条通路,其中 MAPK 信号通路富集得分最高。泛素组学分析也显示,TRIM16 主要调控 MAPK 信号通路中的相关分子。
图片来源:Cell Metabolism
MAPK 信号通路有多种分支类型,其中主要包括 ERK、JNK 和 p38 等等。作者通过 western blot 分析证实,在 PAOA 处理的肝细胞中,过表达 TRIM16 可抑制 JNK1/2 和 p38 的激活,反之亦然,但 ERK1/2 的磷酸化没有受到影响。这些结果表明在 NASH 中,TRIM16 可抑制 JNK-p38 通路的激活。
图片来源:Thermo Fisher
TRIM16 促进磷酸化的 TAK1 的蛋白酶体降解
TRIM16 又是如何抑制 JNK-p38 通路激活的呢?
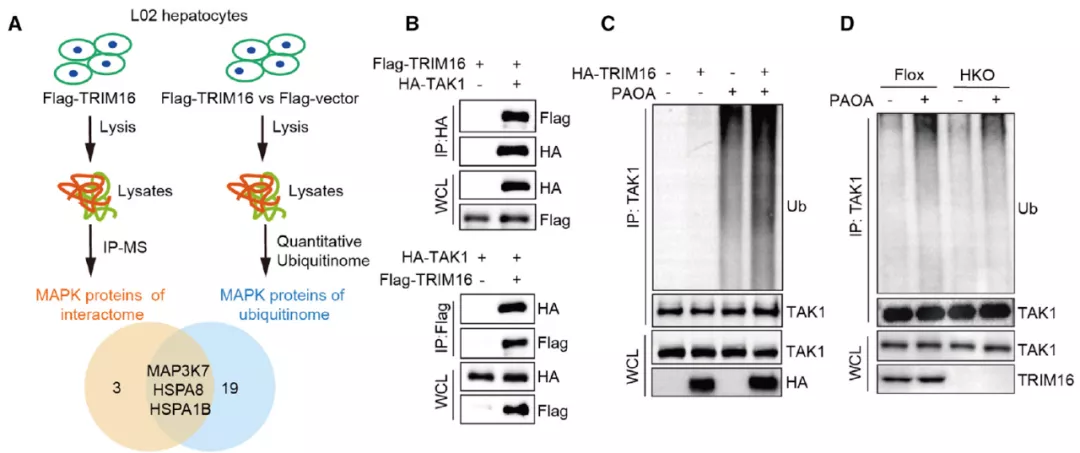
为了确定 TRIM16 抑制 JNK-p38 通路的具体靶点,作者在肝细胞中过表达 TRIM16,并进行了免疫沉淀 - 质谱(IP-MS)分析。通过整合 IP-MS 和定量泛素组学的结果,作者筛选到 3 个 MAPK 通路成员,其中 TAK1(也叫 MAP3K7)已被证实在 NASH 进展过程中发挥关键调控作用,因此作者选择 TAK1 进行了进一步的研究。
图片来源:Cell Metabolism
免疫共沉淀试验和泛素化试验证实 TRIM16 可与 TAK1 相互作用,并介导其泛素化的发生。更加细致的分析发现,突变 TAK1 第 282 和 547 号位上的赖氨酸(K282 和 K547),可消除了 TRIM16 介导的泛素化,提示 K282 和 K547 是 PAOA 处理下 TRIM16 催化 TAK1 泛素化的特定位点。
接下来,作者研究了 TRIM16 催化的泛素化对 TAK1 的影响。作者发现在过表达 TRIM16 的肝细胞中,磷酸化的 TAK1(p-TAK1)减少,反之亦然。然而,令人惊讶的是,总 TAK1 水平保持不变。因此作者猜测,TRIM16 可能主要促进 p-TAK1(而不是总 TAK1)的蛋白酶体降解。在使用蛋白酶体抑制剂 MG132 处理后,TRIM16 对 p-TAK1 的抑制作用消失了。
 图片来源:Cell Metabolism
图片来源:Cell Metabolism此外,在使用 5Z-7 选择性地减弱了 TAK1 的磷酸化后,TRIM16 和 p-TAK1 的相互作用被显著削弱。进一步地,作者将 TAK 的 4 个磷酸化位点(T184、T187、S192 和 S412)分别用丙氨酸(TAK1-4A,模拟去磷酸化)或天冬氨酸(TAK1-4D,模拟磷酸化)替代,发现 TAK1-4A 与 TRIM16 仅表现出微弱的相互作用,而 TAK1-4D 与 TRIM16 的相互作用增强。泛素化试验也与这一结果相符。
接着,作者通过动物模型验证了 NASH 进程中的 TRIM16-TAK1 信号轴的作用。作者发现通过 5Z-7 抑制 TAK1 磷酸化,可以消除 TRIM16 缺失导致的 NASH 恶化,进一步表明在 NASH 中,TRIM16 通过调控 p-TAK1 而发挥细胞保护作用。

图片来源:Cell Metabolism
最后,作者探究了 TRIM16 在 NASH 治疗中的效果。作者将表达 TRIM16 的腺相关病毒 8(AAV8)注射到高脂高胆固醇喂养的小鼠中,并继续以这样的饮食喂养 8 周。结果发现,TRIM16 过表达显著缓解了小鼠肝脏中的脂质积累、炎症、纤维化和肝损伤的情况。
研究总结
在本研究中,作者整合多组学分析,筛选得到 E3 泛素连接酶 TRIM16 作为减轻 NASH 的候选分子。
作者发现 TRIM16 过表达可以缓解小鼠 NASH 模型中的脂质积累和炎症,而 TRIM16 缺失会加重脂质积累和炎症。
机制上,TRIM16 促进了 p-TAK1 的泛素化降解,进而抑制 MAPK 信号通路的激活来抑制 NASH 进展。
总之,这些结果提示 TRIM16 可能作为 NASH 的一个潜在的治疗靶点。

图片来源:Cell Metabolism
参考文献
1.A. J. Sanyal, Past, present and future perspectives in nonalcoholic fatty liver disease. Nat Rev Gastroenterol Hepatol 16, 377-386 (2019).
2.Z. M. Younossi et al., Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 64, 73-84 (2016).
3.Z. Chen, Y. Yu, J. Cai, H. Li, Emerging Molecular Targets for Treatment of Nonalcoholic Fatty Liver Disease. Trends Endocrinol Metab 30, 903-914 (2019).
4.L. Wang et al., Tripartite motif 16 ameliorates nonalcoholic steatohepatitis by promoting the degradation of phospho-TAK1. Cell Metabolism, (2021).
5.S. Schuster, D. Cabrera, M. Arrese, A. E. Feldstein, Triggering and resolution of inflammation in NASH. Nat Rev Gastroenterol Hepatol 15, 349-364 (2018).
题图来源:站酷海洛 Plus