熬夜不睡,肠道崩溃!看看万能的肠道菌群如何「塑造」免疫的昼夜
丁香学术
271
背景介绍
众所周知,几乎所有动物都遵循与日照相关的昼夜节律。自然光的周期变化会带动饮食和睡眠等有「节律」的行为。
生物钟使动物体的生理过程与昼夜光周期同步,从而可以预测环境的变化。在哺乳动物中,生物钟是由复杂的转录因子网络,在 24 小时的周期内驱动基因「有节律」的表达而实现的。生物钟几乎存在于机体所有组织中,并通过来自大脑「中央时钟」的神经元和激素信号与实现与环境光周期的同步。
肠道中的许多生物过程均表现出由生物钟产生的日常节律效应。然而,肠道的独特之处在于它的许多昼夜节律同样也需要肠道微生物群的参与。例如,微生物群与生物钟协调,在控制脂质代谢的基因表达中产生节律。
摄食过程中动物会接触环境中或与食物有关的微生物,因此进食行为也会对食源性病原体产生有「节律」的接触。为了防止感染,哺乳动物肠道上皮会产生先天免疫效应物,包括抗菌蛋白(AMP)。这表明肠道先天免疫同样可能表现出「昼夜节律」特征。
尽管近年来相关研究对微生物群-时钟相互作用如何调节代谢的了解越来越多,但我们对这些相互作用如何调节肠道先天免疫知之甚少。
在最近一项研究中,来自美国德克萨斯大学西南医学中心的 Lora V. Hooper 课题组揭示了肠道微生物群和生物钟协调产生肠道先天免疫的昼夜节律。相关结果发表在最近的 Cell 杂志上。

图片来源:Cell
该研究发现节律性的宿主进食行为导致分段丝状细菌(SFB)在肠道表面的附着产生节律。而节律性的 SFB 附着则进一步驱动上皮 STAT3 的表达和激活,从而调节上皮 AMP 表达并产生昼夜节律振荡特征。这些先天免疫节律导致对鼠伤寒沙门氏菌感染的抵抗力在昼夜循环中发生变化。
研究内容
1. 微生物群影响肠道抗菌蛋白表达的昼夜节律
首先,作者检查了再生胰岛衍生蛋白3γ(REG3G)在肠道先天免疫系统中的节律性表达。REG3G 由小肠上皮分泌并具有杀伤革兰氏阳性菌的能力。
研究发现,Reg3g 基因及其编码蛋白(REG3G)的表达在常规小鼠中呈昼夜节律性,在 Zeitgeber 时间(ZT)0 时的表达低于 ZT12,其中 ZT0 时出现光照,ZT12 光照熄灭。此外,在所有时间点,无菌小鼠的 REG3G 表达均较低,并且没有节律性。因此,REG3G 表达被认为具有昼夜节律,并且维持该节律性特征需要微生物群的参与。
除此之外,作者还发现其它上皮 AMP 也表现出节律性表达的特征。其中包括:lipocalin-2 (LCN2),一种限制细菌铁获取的 AMP;以及 S100A8,一种限制细菌钙获取的 AMP。
相比之下,其它先天免疫基因的表达则是无节律的,其中包括:Lyz1,负责编码溶菌酶;以及产生活性氮物种 (Nos2) 和粘液 (Muc2) 所必需的基因。因此,研究表明多种 AMP 具有节律性表达的特征,但不是肠道先天免疫系统的普遍特征。

图 1. 昼夜节律调节肠道抗菌肽的表达
2. 分段丝状细菌(SFB)的「节律性上皮附着」驱动抗菌蛋白表达的昼夜节律产生
接下来,作者试图确定驱动 AMP 节律性表达的微生物群成分。
小鼠小肠表面的扫描电子显微镜(SEM)结果显示了许多具有分段丝状形态的附着细菌(SFB)。SFB 是存在于啮齿动物、非人类灵长类动物和人类肠道微生物群中的革兰氏阳性菌。SFB 具有独特的形态,其特征是长而分段的细丝,并且具有紧密附着于肠上皮细胞并刺激宿主基因表达的独特能力。
为了测试 SFB 是否在 REG3G 表达中产生节律,作者研究了来自两个不同供应商的小鼠:Taconic Farms 小鼠和 Jackson Laboratory 小鼠。SFB 存在于 Taconic 但不存在于 Jackson 小鼠中。研究结果显示,REG3G 表达在 Taconic 小鼠中是有节律的,而 Jackson 来源的小鼠则没有上述现象。这一结果表明 SFB 可能驱动了肠上皮中 REG3G 有节律的表达。
进一步,扫描电镜结果揭示了具有 SFB 定植的小鼠小肠表面存在有规律的 SFB 附着现象,并且于 ZT12 其附着量达到顶峰,与 REG3G 表达的峰值一致。相反地,Jackson 来源的小鼠的小肠表面则没有 SFB 附着。
之后,作者通过 SFB+ 和 SFB- 小鼠的共饲养操作将 SFB 引入 SFB- 小鼠,结果显示,该处理能够导致有节律的细菌附着和 REG3G 表达的震荡。这些发现表明有节律的 SFB 附着到小肠上皮驱动抗菌蛋白表达的昼夜节律。
接下来,作者还考虑了 REG3G 表达是否可能反过来驱动有节奏的 SFB 附着。其原因是如果 REG3G 能够杀死 SFB 或与 SFB 竞争小肠上皮附着的细菌,就会导致上述情况的发生。
然而,实验结果不支持该想法。首先,峰值 SFB 附着与峰值 REG3G 表达一致。其次,SFB 附着在 Reg3g 缺陷型小鼠中同样保持昼夜节律。这些数据表明 REG3G 不会驱动 SFB 的节律性附着。
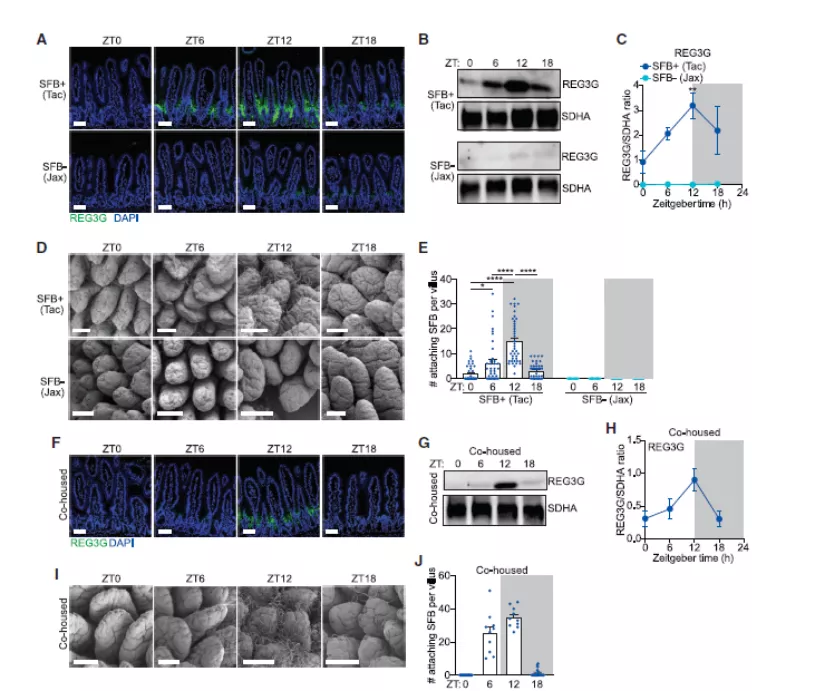
图 2. SFB 肠道附着呈现昼夜节律特征
3. ILC3-STAT3 信号驱动 REG3G 的节律性表达
REG3G 表达需要通过 Toll 样受体(TLR)和 下游信号分子 MYD88 进行信号传递。研究表明,相比野生型小鼠,Myd88-/-小鼠体内 REG3G 在 ZT0 和 ZT12 处的表达都很低。
尽管 Myd88 在肠上皮细胞对有规律的 REG3G 表达来说不是必需的,但在 CD11c+ 髓样细胞中却是必需的:CD11c+ 细胞和 ILC3 的免疫细胞信号通路驱动包括 Reg3g 在内的上皮基因的表达。在该回路中,CD11c+细胞 TLR-MYD88 信号触发白细胞介素 (IL)-23 的产生,从而引发 ILC3 产生 IL-22。IL-22 激活上皮细胞 STAT3 以驱动 Reg3g 表达。
SFB 的上皮附着触发 ILC3-STAT3 并刺激包括 Reg3g 在内的基因的表达。CD11c+ 细胞中 Myd88 的必要性表明 SFB 可能通过 ILC3-STAT3 途径产生 REG3G 节律。
为了测试是否需要 ILC3 的参与,作者研究了缺乏编码 RAR 相关孤儿受体γ (RORγt) 的 Rorc (Rorcgfp/gfp) 小鼠。RORγt 是一种转录因子,控制着产生 IL-22 的细胞的发育,包括 ILC3、Th17 细胞和 γδT 细胞。
研究表明,Rorcgfp/gfp 小鼠中的 REG3G 表达在 ZT0 和 ZT12 处均较低,表明产生 IL-22 的细胞在驱动 REG3G 节律方面具有重要作用。
然而,在缺乏重组激活基因 1(Rag1)的小鼠中,REG3G 表达在 ZT0 处较低,在 ZT12 处较高。在该基因型小鼠中,缺乏成熟的 T 和 B 细胞,但保留 ILC3,因此这些发现排除了 Th17 和 γδT 细胞的可能性,提示是 ILC3 促进 REG3G 的节律性表达。
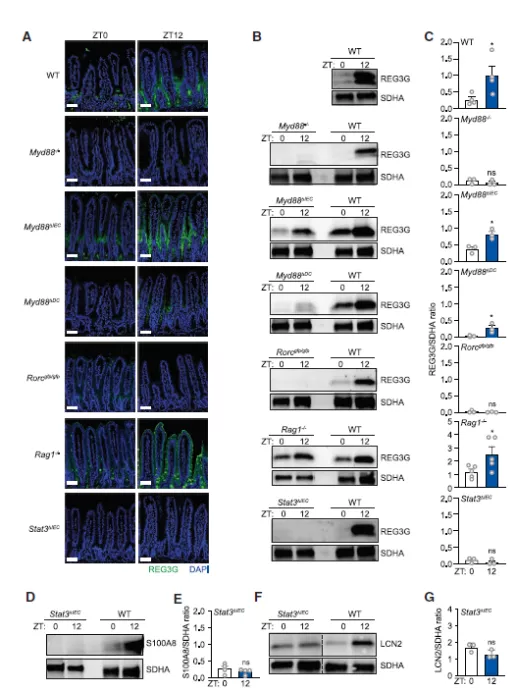
图 3. ILC3-STAT3 信号驱动 REG3G 的节律性表达
为了测试 REG3G 的规律性表达是否需要 STAT3,作者构建了上皮细胞特异性 Stat3 缺陷型小鼠——Stat3ΔIEC 小鼠。研究表明,该小鼠中 REG3G 的表达水平在 ZT0 和 ZT12 处均较低,表明 STAT3 是 REG3G 节律所必需的。
同样,在 Stat3ΔIEC 小鼠中,S100A8 和 LCN2 在 ZT0 和 ZT12 处的表达都很低,表明上皮 STAT3 也是多种 AMP 的节律表达所必需的。
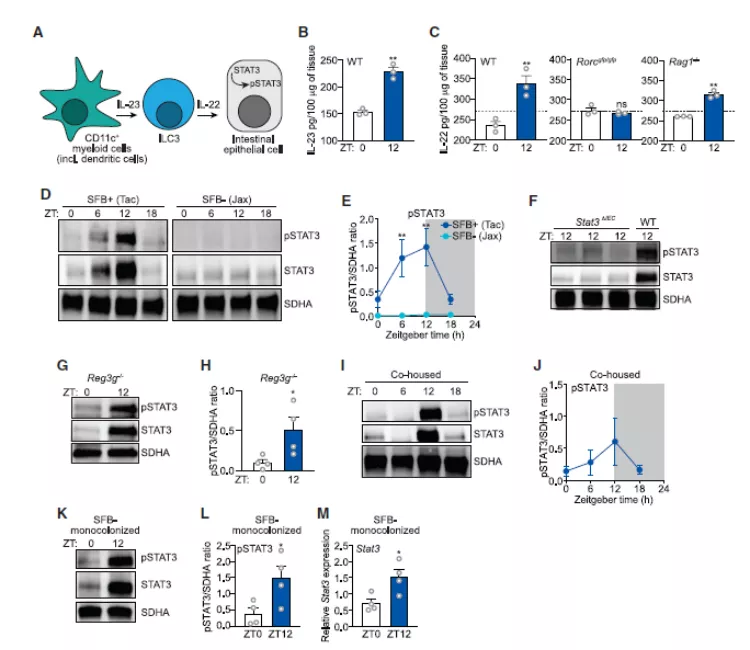
图 4. SFB 驱动 STAT3 的节律性激活
之后,作者通过一系列实验证明了 SFB 驱动 STAT3 表达的昼夜节律的产生,而生物钟在调控 SFB 的节律性肠上皮附着中也起着重要的作用。作者发现,生物钟主要通过调控动物的进食行为,从而达到调节 SFB 规律性附着的目的。
研究总结
生物钟通过昼夜光循环协调动物体的各项生理过程,使动物能够预测其环境的变化。在这项研究中,作者表明生物钟同样能够协调肠道先天免疫与宿主进食节律,从而有助于预测食源性细菌的暴露风险。
研究发现:在生物钟的影响下,宿主的进食行为会产生 SFB 在肠道上皮附着的节律性变化,而 SFB 的节律性附着能够刺激髓样细胞中 ILC3 免疫信号回路,驱动上皮 STAT3 表达和激活。STAT3 的节律性激活导致抗菌蛋白的振荡表达,包括 REG3G、LCN2 和 S100A8。 通过这种方式,宿主进食节律与肠道先天免疫节律达成了同步。
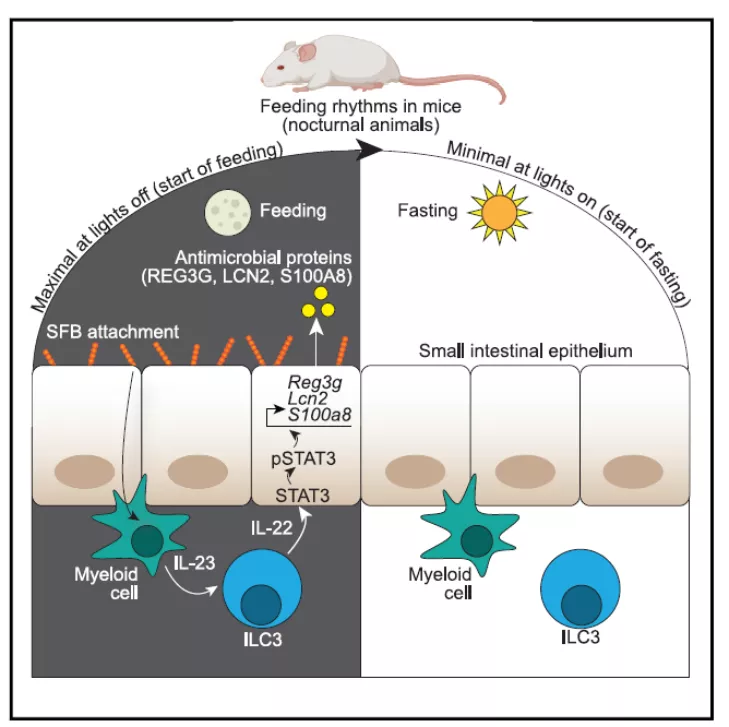
图片来源:Cell
除饮食之外,该研究还突出了健康作息对于预防肠道病原体感染的意义。此前研究发现:慢性睡眠中断与人类感染的易感性增加有关。 例如,与白天工作的人相比,晚上工作的人对细菌和病毒感染的易感性更高。 本研究结果表明,进食行为的改变可能是其中一个潜在的致病因素。
通过确定生物钟驱动微生物群功能昼夜节律的机制,可以进一步阐明微生物群的节律功能如何影响宿主免疫。这些研究可能会为定时治疗干预和疫苗接种方案的开发提供新的思路。
题图来源:站酷海洛
参考文献:
Brooks JF 2nd, Behrendt CL, Ruhn KA, et al. The microbiota coordinates diurnal rhythms in innate immunity with the circadian clock [published online ahead of print, 2021 Jul 21]. Cell. 2021; S0092-8674(21)00827-8. doi:10.1016/j.cell.2021.07.001