这个研究斩获近 7 亿国自然资助
丁香园
一点一点,一秒一秒,我会渐渐失去所有的记忆,我不再记得你,不记得我们之间的一切,我脑海里有个橡皮擦,擦掉我们之间的所有。
——《我脑中的橡皮擦》
阿尔茨海默症(AD)大家并不陌生,目前我国 65 岁以上老年人中就有 900 万人患有这种疾病。记忆是一种宝贵的财富,他们却无法控制记忆的失去。
为了减轻疾病给患者及其家人带来的痛苦,应对人口老龄化带来的社会压力,国家自然科学基金委员会一直在加大对阿尔茨海默症研究的资助:2001~2005 年,资助经费达到 1 506.4 万元,2006~2010 年达到 7 814.5 万元,2011~2017 年已达到 5 7247.5 万元。
不仅如此,社会各界人士同样关注这项疾病,去年年底比尔盖茨就为此投入 1 亿美元用于研究,希望在未来的 10 年内一些有用的药能够诞生。
从事神经衰退疾病研究的人不断尝试从各种角度去预防或治疗这个疾病。其中 Tau 蛋白 相关研究不得不提。它集中存在于中枢神经系统当中,有稳定微管的作用,当它产生病变(过度磷酸化 / 糖基化)时,会引起阿尔兹海默氏症等神经衰退类疾病。
Tau 蛋白在正常人体内的主要功能是诱导与促进微管蛋白聚集成微管,并维持其稳定性。它的微管结合能力由翻译后修饰来控制,其中磷酸化修饰是主要方式之一,正常情况下磷酸化修饰的水平较低,而过度磷酸化则会导致 Tau 蛋白失活,无法集结微管蛋白,致使神经细胞变性。由于 Tau 蛋白有多个磷酸化位点,并且参与调节的蛋白激酶和磷酸酯酶又不止一种,所以这使得 AD 的发病机制非常复杂。
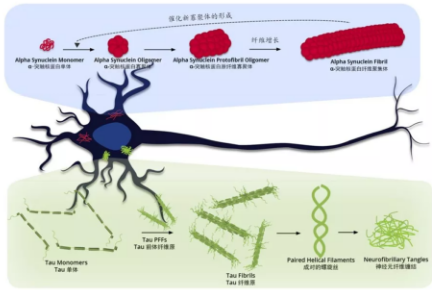
成人大脑中有 6 种 Tau 蛋白亚型,其中三种是有三段微管结合重复区域 (3R-tau),另三种是有四段微管结合重复区域(4R-tau)。Tau 全长蛋白被记做 2N4R 或 Tau-441,共有 441 个氨基酸残基,其他亚型的结构及标记如下图。其中 K18 和 K19 是截短的 Tau 蛋白,仅含有微管结合重复区域。

和 α- 突触核蛋白 PFFs(Pre-formed Fibrils) 相似的是,Tau PFFs 也被称为「种子」,有催化可溶性 Tau 蛋白聚集形成纤维缠结的作用。而与 α- 突触核蛋白 PFFs 不同的是,Tau PFFs 在正常神经细胞中的催化作用要慢得多,这是因为突变的 α- 突触核蛋白单体(A53T)在正常神经细胞中就存在,并且集中于神经突触前体末端,而突变的 Tau 蛋白单体并不自然存在于正常神经细胞中,并且 Tau 蛋白比较分散的位于轴突当中,浓度较低,不利于快速聚集形成纤维缠结。有多方研究表明,突变的 Tau 蛋白 PFFs 催化聚集过程要比野生型 Tau 快很多,而突变型全长 Tau PFFs 的催化聚集能力又比截短的 Tau PFFs 要有效一点。
为了克服 Tau 蛋白聚集沉积过程慢的难题,StressMarq 推出四种活性 Tau 蛋白,可以加速 Tau 纤维缠结的形成。
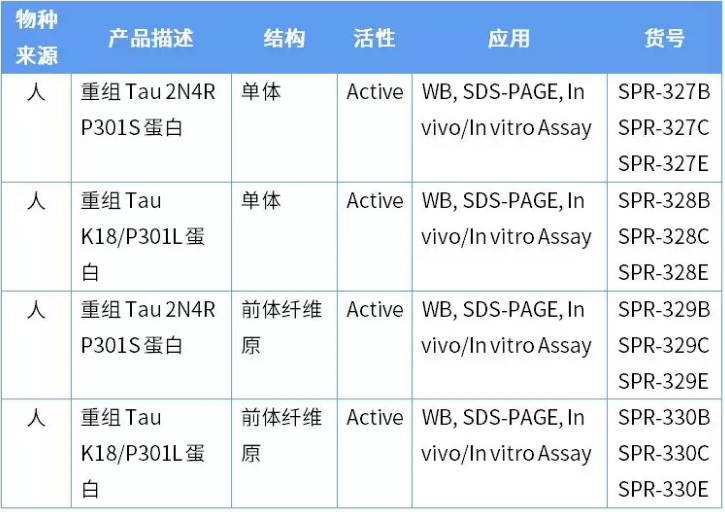
其中 P301S 是指在外显子 10 上发生的突变,该突变型 Tau 的微管结合能力受损。P301L (PL) 是另一种突变型,在 Tau 密码子 301 位置的脯氨酸突变成为亮氨酸,这种突变与额颞叶痴呆相关。下图是这几种蛋白随时间的变化情况,硫黄素 T 是一种荧光染料,和富含 Beta 折叠的结构结合,用来标记 Tau 聚集体的量变情况。

硫黄素 T 是一种荧光染料,可以绑定富含 beta 折叠的结构,例如 tau 纤维原。绑定之后,硫黄素T光谱会发生红移,荧光强度会增强。硫黄素 T 荧光曲线显示活性 tau 单体(SPR-327)荧光强度增加(相关于 tau 聚集)。当 50 uM 活性单体(SPR-327)与 10 nM 活性纤维原(SPR-329 或 SPR-330)混合的时候,荧光强度增加的更明显,这是因为活性纤维原起到了「种子」的作用,聚集活性单体形成更多纤维原. 硫黄素 T 激发光波长 = 450 nm, 发射光波长 = 485 nm.



![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)