跑个漂亮的 Caspase-3 结果图,真的那么难吗?
丁香园

Caspase-3(CPP-32,Apoptain,Yama,SCA-1),半胱天冬酶家族成员之一,是凋亡的关键执行者,对许多关键的蛋白起着部分或全部的裂解作用,如核酶多聚(ADP-ribose)聚合酶(PARP)[1] 及众多细胞骨架相关的蛋白、激酶以及 Bcl-2 家族中凋亡相关的蛋白等[2] 。
Caspase-3 在肺、脾脏、心脏、肝脏、肾脏等中广泛表达,在大脑和骨骼肌中表达量稍低,在睾丸中表达量最低。同时在许多细胞系中都有发现 caspase-3 的表达,其中免疫相关的细胞中表达量最高[3] 。但据报道,MCF-7 人乳腺癌细胞系中,因在 CASP-3 基因 exon 3 中存在 47bp 的缺失而不表达 caspase 3 蛋白[4] 。
前体形式的 caspase-3 由一个前端功能区(prodomain)和一大一小两个催化亚单位构成。在特定的刺激比如配体受体互作、生长因子匮乏和细胞功能抑制剂等的作用下,未活化的酶原形式的 caspase-3 在 Asp-28/Ser-29(N 端功能前区)以及 Asp-175/Ser-176(大小亚基之间)被剪切活化,转变为活化的 p17 大亚基和 p12 小亚基片段。p17 和 p12 会二聚化,从而形成最终活化形式的 cleaved caspase-3[5,6] 。
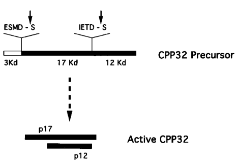
图一 Caspase-3 活化示意图(图片源自文献 Zhiyong Han et al. (1997) J. Biol. Chem. 272, 13432–13436)
凋亡过程中最重要的事件之一即是 caspase-3 的活化,因此 cleaved caspase-3 的检测是凋亡研究中的常用手段。但在以往的技术咨询中我们发现不少老师在检测 cleaved caspase-3 时遇到问题。经过大量数据总结我们发现,老师们之所以检测不到 cleaved caspase-3,最主要的原因还是样本中没有足够比例的凋亡细胞。这种情况下我们该如何应对呢?CST 博士团队给您支个招,不妨翻翻实验记录,问问自己以下 7 个问题:
01 我诱导凋亡的方式合理吗?
Cleaved caspase-3 仅仅存在于正在发生凋亡的细胞中,未发生凋亡,或已经坏死的细胞中是检测不到 cleaved caspase-3 的。因此,样本的诱导处理显得尤为关键。细胞系、诱导试剂的浓度、诱导的时间长短等,对最终发生凋亡的细胞数量及其中 cleaved caspase-3 的量都会产生很大的影响。所以,根据不同的细胞系,诱导试剂的浓度、诱导时间长短都需要进行适当的摸索。我们建议客户在检测到 procaspase-3 的前提下,做时间和浓度梯度预实验,以确定您的药物对您的细胞系的最佳诱导 caspase-3 活化的条件。CST 通常用 staurosporine #9953(1μM for 3hours)或 etoposide #2200(25μM for 5 hours)处理 HeLa,NIH/3T3 或 C6 cells 作为 cleaved caspase-3 的阳性参照。更多靶点的阳性对照,请登陆CST网站——研究——靶标的阳性对照处理。
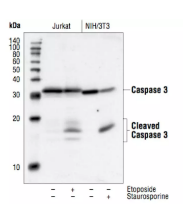
图二 蛋白质印迹分析
(图源自CST Caspase-3 Antibody #9662 抗体说明书)
为什么所有的实验都要设置对照?无论是初高中刚接触生物学实验设计还是上研究生后发表 SCI 文章,老师们以及 reviewer 都会敲着「黑板」强调强调再强调,每一个实验都必须有对照!因为设置适当的阴性、阳性甚至空白对照对于实验结果的准确、有效阐释至关重要!阅历丰富的老师应该和笔者一样深有感触:实验条件、样本类型之间生物学条件、试剂特异性甚至研究人员的差异都可能产生不一致的结果,导致不准确的结论。
02 我的细胞系是贴壁细胞吗?
因为贴壁细胞在发生凋亡后,有可能会变得比较难贴壁,所以有必要通过离心收集所有的悬浮细胞,一并混到刮下来的贴壁细胞中一起裂解。
03 裂解细胞时我超声了吗?
CST 研发科学家做过对照试验,与不超声相比,超声能最大程度地、均一稳定地提取 caspase-3,得到更强的信号。因此,CST 科学家建议在加入 1X 细胞裂解液(稀释成 1X 的 Blue Loading buffer Pack #7722 或 Red Loading buffer Pack #7723 或 Cell Lysis Buffer (10X) #9803 或 RIPA Buffer (10X) #9806)后、上样前对所有的样本进行超声处理。超声条件:在 35%~40% 的功率输出条件下破碎 3 次,每次 10 秒,各次之间间隔 10 秒,冰上操作。但不同的超声仪器有不同的性能,应根据生产商的建议进行个性化优化。如果您没有探头超声仪,也可用细的注射器针头反复吹打来破碎。
04 我的蛋白上样量足够吗?
对于组织提取的蛋白,由于只有一小部分细胞可能会发生凋亡。因此,CST 科学家建议每个孔上样 100 μg。而对于诱导的细胞系提取的蛋白,20~30 μg 就足够了。
05 我用的跑胶条件合适么?
我们通常强烈建议用 16% 或 4~20% Tris-Glycine 胶检测 cleaved caspase-3(17, 19k Da)。如果是用 Bis-Tris 胶,最好用更适应于小分子量电泳的 MES 跑胶缓冲液,而不是 MOPS 跑胶缓冲液。
06 我转膜用的膜孔径大小对么?
对于小分子量的靶标蛋白(比如 cleaved caspase-3),避免过转非常重要。我们推荐的转膜条件如下:0.2 μm 孔径膜,湿转,70V(200-250 mA)不超过 1.5 小时。转膜液 25 mM Tris,192 mM Glycine,和 20% methanol。0.2 μm 的孔径能最大程度的减少转膜过程中小分子量蛋白的丢失。另外,也有文献表示,使用戊二醛固定 NC 膜 30 min,能稳定 caspase-3 与 NC 膜的结合,从而促进 caspase-3 的检测[7]