一文搞清蛋白质相互作用的研究方法 | 实验时间
丁香园
相当多的蛋白质行使功能的时候并不是单打独斗的,蛋白质们通过蛋白质相互作用形成复合体然后进行工作,在工作的过程中,蛋白质们也可以通过更换相互作用的伙伴,从而改变蛋白质复合体的功能。
因此,研究蛋白质的相互作用成为研究蛋白质功能和作用机制的最为重要的环节之一。
另外,蛋白质相互作用的本质其实是三种力,氢键,分子间作用力(范德华力)和疏水力,因为这三种力的作用距离都非常的短,所以相互作用的蛋白我们通常认为它们必定相互接近,尽管这是个充分非必要命题,但是我们常常使用这个命题的逆命题来进行实验检测。
那么,如何对这个问题进行研究呢?这里狗哥就带大家简单梳理一下常用的蛋白质相互作用的研究方法。

图 1
<1>
酵母双杂交,Yeasttwo hybrid(Y2H), 这是一个古老的技术,Stanley Fields 和 Ok-KyuSong 在 1989 年的时候利用大肠杆菌中 GAL4 乳糖操纵子的原理,开发出这个方法用于检测蛋白质之间的相互作用 。
GAL4 操纵子有两个结构域,BD(binding domain)结构域和 AD(activation domain),其中 BD 结构域可以结合在 UAS(upstreamactivating sequence)DNA 区域,在 AD 结构域可以激活 UAS 下游的基因表达。
因此,他们把 GAL4 的两个结构域切分开,这样,BD 可以与目标蛋白结合,并且先行结合在报告基因 lacZ 上游的 UAS 区域,接着,把需要检验是否与目标蛋白相互作用的蛋白与 AD 结构域融合表达,如果目标蛋白和被检测蛋白可以相互作用,它们必定会在空间上相互接近彼此,这种相互作用可以使得 AD 和 BD 结构域也在空间上相互接近,这样就可以激活报告基因 lacZ 的表达,使得人们可以检测到,如图 1 所示 。
这个方法的优势在于廉价且易操作,这个方法一度非常流行,既可以用于筛选目标基因的相互作用蛋白,也可以用于验证相互作用,以及定量检测相互作用的强度。
但是缺点在于受试蛋白都需要和 AD/BD 结构域形成融合蛋白,空间构象可能改变,其次,许多蛋白质的相互作用可能同时需要其他蛋白的协助,而这个系统并无法把这些辅助蛋白也拉进来检测,因此经常漏掉很多的蛋白相互作用,第三,由于反应发生在真菌细胞内,如果你的目标蛋白来自其他物种,这个实验可能并不能反应蛋白在原物种细胞里的真实状态,最后,有的蛋白质可能自身就能够激活报告基因表达,比如转录因子,这样,这类蛋白就没办法通过酵母双杂交进行筛选和验证相互作用了(当然也可以将该蛋白换至 AD 载体上,但是依然有其局限性)。
<2>
荧光共定位,Fluorescenceco-localization,在过去,这个技术一般用于细胞内辅助证明蛋白相互作用,前些年,如果是其他物种的蛋白质,你应用酵母双杂交系统验证了它们的相互作用,reviewer 可能会说你这个并不能反映原物种中的真实情况,可能是假阳性。
这个时候,一些研究者就将这两个蛋白分别与不同颜色的荧光蛋白融合表达于原物种细胞当中,在高分辨显微镜下,如果两种荧光出现在同一位置,那么就证明它们空间上较为接近,很有可能产生了相互作用。然而,就如上一句话里所说的,只是很有可能,并不能作为直接证据证明它们真的相互作用了。这个技术一般都是没办法时候的办法,就不举例子啦。
<3>
荧光双分子互补, bi-molecular fluorescence complementation(BiFC), 人们把绿色荧光蛋白 GFP 分子分割成两段,分别与接受测试的两个蛋白融合表达。如果两个蛋白相互作用,那么在细胞中 GFP 的两个片段就可以在空间上相互接近,并最终能够在激光的激发下发出绿色的荧光 ,如图 2 所示。
这里的 GFP 也可以换成萤火虫荧光素酶 Luciferase,原理相同,不同的是荧光素酶需要有底物的存在,发出的是自发荧光而非激发光 。这类技术的好处是可以再活细胞里进行观测,可以进行实时监控,定量等实验。
但是该技术的空间分辨率大概是 250nm,可以说对于蛋白质相互作用来说,依然是相当远的一个距离,因此也有很大可能是假阳性,同时融合蛋白也可能对受试蛋白的空间构象造成影响造成假阳性假阴性的结果。总的来说,这类技术还是要优于前两个的。

图 2
<4>
荧光能量共振转移,fluorescence resonance energy transfer(FRET),这个技术与第三条又有所不同。
人们将目标蛋白 A 与青色荧光蛋白 CFP 融合表达,将 A 的可能的互作蛋白 B 与黄色荧光蛋白 YFP 融合表达,CFP 的激发光是波长是 414nm 紫外光区域,而荧光波长是 475nm 蓝光区域,恰好 YFP 的激发光是 475nm 附近蓝光区域,而荧光则是 525nm 附近黄色光区域。如果 AB 两蛋白相互作用,空间上相互接近,导致 CFP 和 YFP 分子也在空间上相互接近,那么当仅用紫外光激发 CFP 时,CFP 接收能量放出的蓝光将直接被 YFP 吸收,从而发出黄色的光, 如图 3,如果能够定量 CFP 的蓝光被转化成为 YFP 的黄光效率的变化,那么就可以检测出两个蛋白间的距离的变化 。
因此,这项技术不仅能验证蛋白质的相互作用,还能够表征这种相互作用距离的动态变化,比如蛋白质分子直接相对运动的方向速度等。比如在这篇文章里 ,作者们就用 FRET 测定了细胞运动时的受力情况。
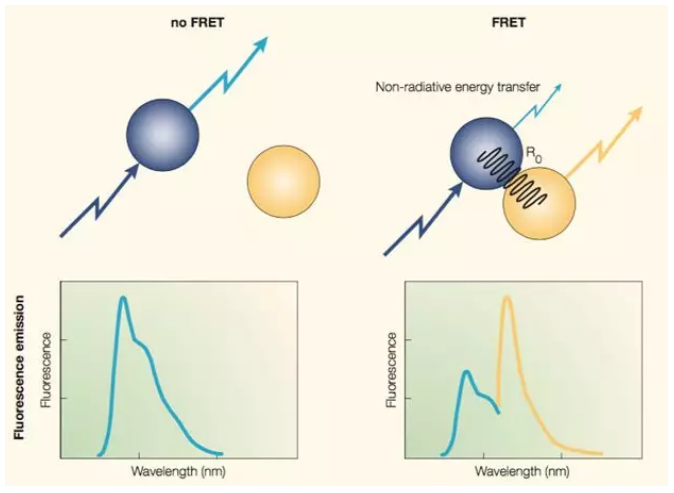
图 3
<5>
免疫共沉淀,coimmuno-precipitation(co-IP),这个技术呢,其原理是利用抗原抗体的亲和性来验证蛋白质之间的相互作用。
人们将抗体和大质量的琼脂糖颗粒或者磁珠进行进行交联或者亲和,然后用这个带有抗体的大颗粒物去识别溶液中的目标蛋白,此时如果目标蛋白已经与其他蛋白相互作用形成复合体,那么含有目标蛋白的蛋白复合体就会被这些大质量的颗粒物所亲和,由于抗体锚定在了这些大质量的颗粒物上。
人们通过各种缓冲液的清洗除去非特异性的结合后的颗粒物可以通过离心或者磁力架吸引进行收集,此时结合在这些颗粒物上的蛋白质理论上就是可以和目标蛋白直接或者间接相互作用的蛋白了。
通常情况下,做实验前你对于这些可能的互作蛋白已经有了猜测,那么可以将大颗粒物拖拽下来的蛋白复合体跑 SDS-PAGE。
然后用 western-blot 的方法,可以用这些可能的互作蛋白的抗体去进行检测,就能验证这种蛋白质之间的相互作用了,如图 4。根据实验目的的不同,免疫共沉淀的方法可以有很多可以修改的地方。
比如,如果你希望验证蛋白之间直接的相互作用,那么你可以选择体外翻译系统,在试管中合成需要验证互作的一对蛋白,然后混合孵育,并进行检测,也可以通过原核表达系统纯化这对蛋白,然后进行混合孵育并检测等等。免疫沉淀的方法运用合理,可以玩出很多有意思的实验,回答很多问题。
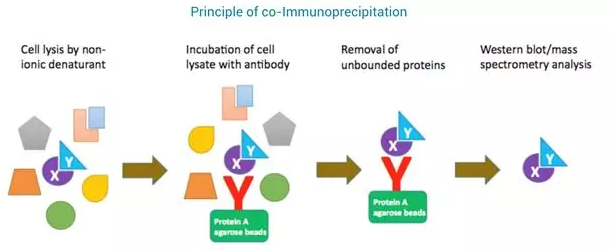
图 4
<6>
亲和纯化 - 质谱,affinity purification-mass spectrometry(AP-MS),刚才说了,如果你在实验之前已经对目标蛋白有推测的互作蛋白,那么你可以做 western-blot 对它进行检测。
可是,如果你想找一些以前未被报道,你自己也无法猜测的新互作蛋白呢?这个时候,你可以把免疫共沉淀后得到的样品,送去做蛋白组学质谱的实验室,通过质谱对这个复合体中的所有成员进行鉴定,理论上你就获得了整个目标蛋白复合体的成员信息,如图 4。
如果说,之前的实验都是用一把枪,瞄准对面山头的敌人然后各个击破,那么质谱的方法就是拿了一门炮,将对面山头的敌人一网打尽。AP-MS 的方法还有很多变种。
比如利用一些可以对周围蛋白进行生物素标记的酶,我们可以将目标蛋白与这些酶融合表达,那么,在细胞内,这些融合蛋白就可以对目标蛋白附近的所有蛋白打上亲和素的标记,然后通过生物素与亲和素超强的亲和性,我们可以大幅提高 AP-MS 鉴定的灵敏度,在冲洗非特异性结合的时候,我们就不用担心弱相互作用被我们丢失,这类方法叫做邻近标记(proximity labeling)- 质谱法。
狗哥帮助大家把主流的研究蛋白质相互作用的方法都梳理了一遍,从此导师再也不会担心我的课题了,不过关于实验设计,还是需要严谨,对照的设计,实验重现性,bait-prey 的互换等等都需要大家在做实验之前认真探讨和考虑。
最后说一句,如今,蛋白质组学研究蛋白互作的方法不仅强大,而且高效快速,如果大家对蛋白质组学的方法感兴趣,狗哥可以再出些文章,跟大家一一探讨。