B 细胞内抗体产生新机制!两篇 Nature 重磅揭示染色质环挤压导致 V(D)J 重组和抗体类别转换重组
人体依靠细胞免疫和体液免疫抵抗多种潜在致病因子的能力时,往往取决于一种称为重组的过程如 V (D) J 重组和抗体类别转换重组(class-switch recombination, CSR)。
重组操纵 DNA 序列,使我们的身体能够产生多种多样的免疫系统识别成分如:抗体和 T 细胞受体(TCR)。
相距甚远的 DNA 区域并列连接在一起,形成了多种编码抗体的免疫系统基因,而这种类型的基因似乎都依赖于通过一种称为黏着蛋白(cohesin)的蛋白质环(ring)DNA 挤压而形成。
2019 年 9 月和 10 月,美国波士顿儿童医院同一个实验室的 Yu Zhang 1 和 Xuefei Zhang 2 等人在 Nature 杂志上连续发表了两篇论文,系统性地揭示了 B 细胞中这种类型的重组事件如何以意想不到的方式产生新的抗体,表明染色质环挤压(chromatin-loop extrusion)也是控制 V (D) J 重组和 CSR 重组的基础。

图片来源:nature
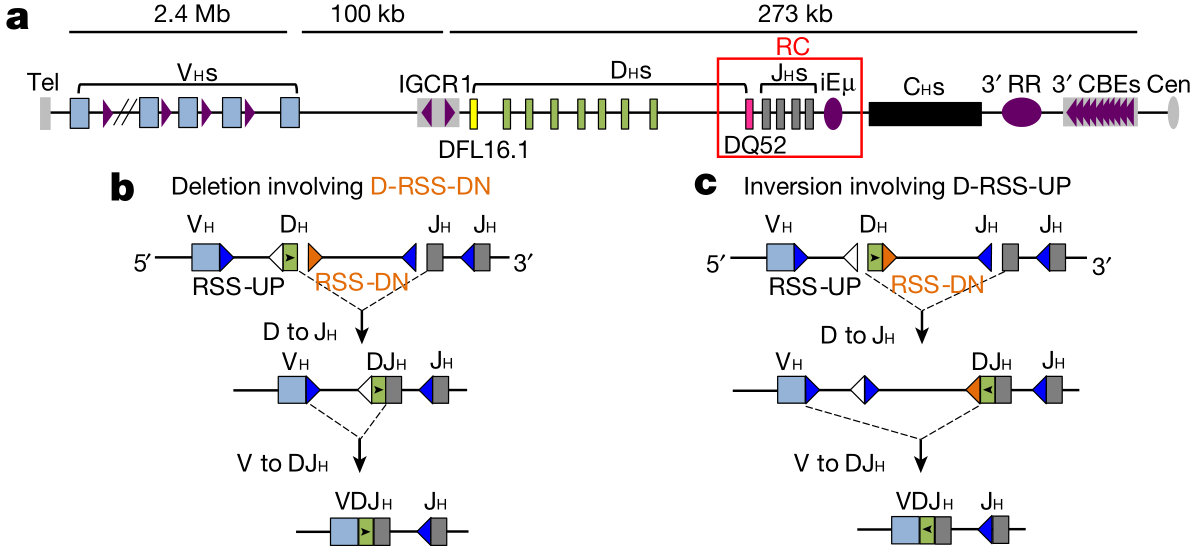
在发育的 B 细胞中,V(D)J 重组过程会使用 V(variable ),D(diversity),J(joining)的三种基因片段将 DNA 重新排列起来,以组装编码抗体的基因。
这些基因片段的两侧是进化上较为保守的称为重组信号序列(recombination signal sequence, RSSs)的 DNA 序列,V(D)J 重组发生在 RSS 和编码序列之间,由重组酶催化。
重组激活基因(recombination-activating gene, RAG)RNG1 和 RNG2 编码的蛋白质是一种核酸内切酶,通过将 D 片段连接到 J 片段来启动 B 细胞前体的 Igh V (D) J 组装,然后再将上游的 V 片段连接到 DJ 中间体上。
这种重组过程便使抗体具有称为可变域(variable domain)的多种蛋白质结构域,可识别抗原的蛋白质片段。
另外,编码抗体的基因有时也会进一步修饰,以改变单个 DNA 碱基产生点突变,从而增强抗体识别抗原的能力。
图片来源:nature
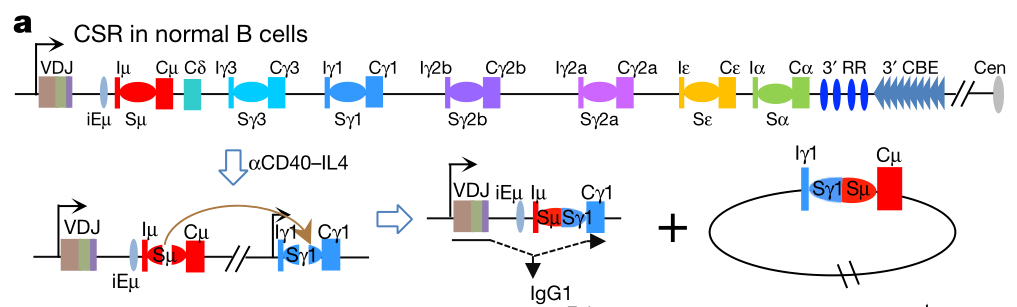
除此之外,抗原刺激 B 细胞后发生重链 DNA 重排,先前产生的 V(D)J 重组基因可与任何 CH 基因片段结合,称为抗体类别转换重组(CSR)。
CSR 由一种称为 AID 的 DNA 突变酶启动,在抗体编码基因的特定转换区(switch region)中引入了 DNA 核苷酸碱基的多点突变,最终导致 DNA 断裂并重组。
不同于 RAG 核酸内切酶介导的 V (D) J 重组的是,AID 在单个 DNA 位点上引起突变,这些突变可导致 DNA 在转换区对齐前后发生断裂,随后这些转换区连接在一起形成新的重链基因。
在 B 细胞发生过程中,膜上最先表达的是 IgM,之后共表达 IgM 和 IgD,经历 CSR 重排后 Ig 类型会转换成 IgG、IgA、IgE 等其他类别或亚类。
这些改变不会影响抗原识别,相反正是抗体重组后的这种多样性使得免疫系统能够有效地应对多种致病因子。
图片来源:nature
主要内容
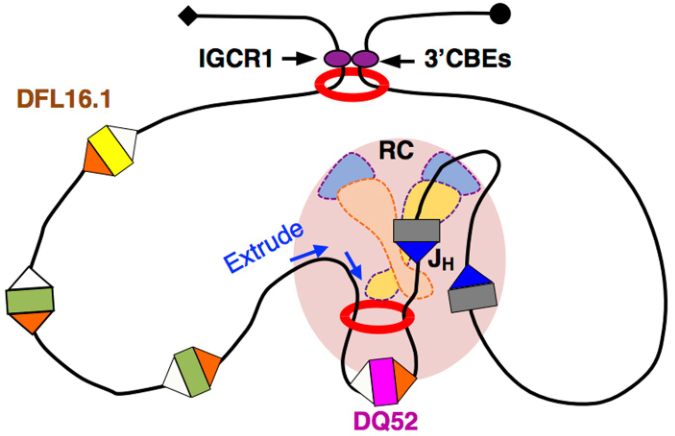
以往的研究发现,V(D)J 重组过程中,RAG 会被募集到修饰的 DNA 组蛋白上,该蛋白以高水平积累在含有抗体 J 基因的染色体区域中,从而产生一个 VDJ 重组中心。
RAG 在该中心结合 J 基因片段侧面的 RSS 序列。然后,RAG 以线性方式扫描染色体其余部分,以找到另一个更远的基因片段的 RSS。相互兼容的 RSS 对齐后,RAG 会诱导 DNA 断裂以启动这两个 RSS 之间的重组。
RAG 会锚定在 VDJ 重组中心,这便引出了一个问题:DNA 在此扫描过程中是如何移动的?
于是在第一篇文章中,Yu Zhang 等假设,染色质环挤压可能解释这种 DNA 运动。
在此模型中,黏着蛋白与结合了 RSS 的 RAG 在 VDJ 重组中心组装后,黏着蛋白通过其环「释放」DNA,使环路中的 RSS 可以找到与 RAG 结合的兼容 RSS,以进行重组。
图片来源:nature
为了验证该模型,研究人员首先使用 CRISPR/Cas9 技术靶向敲除了 v-Abl 转化的 RAG2 缺陷型祖 B 细胞(pro-B)系一个等位基因上的 DH-JH-RC 结构域,称为 DH-JH+/- 亲本系,从而对 D-RSS 方向包含 D-JH-RC 的生理染色体结构域中 D 对 JH 重排和反向重排的影响进行了突变分析。
发现导致删除性 D-to-JH 重组产物占绝大优势的决定因素并不是上游 D-RSS 和下游 D-RSS 的序列,而是两个 D-RSS 的方向差异。
这一差异在 DFL16.1 这一 D 基因片段中,下游 D-RSS 介导 D-to-JH 重组的能力约为上游 D-RSS 的 1000 倍。
为了进一步研究 RAG 在染色质上扫描的机制。研究人员利用 CRISPR/dCas9 技术,在 RAG 扫描路径中的高度重复 DNA 序列中,设计了一个在短距离内多次结合 DNA 的 sgRNA,sgRNA 引导没有 DNA 切割功能但保存了 DNA 结合功能的突变核酸酶 dCas9 结合该重复 DNA 位点。
dCas9 的结合给 RAG 移动造成了一个「路障」,显著的减少了下游 RAG 的切割,而 dCas9 结合位点处则成为了一个新的 RAG 切割位点。ChIP-seq 进一步发现介导环挤压的黏着蛋白在 dCas9 结合的 DNA 位点上有显著的积累。
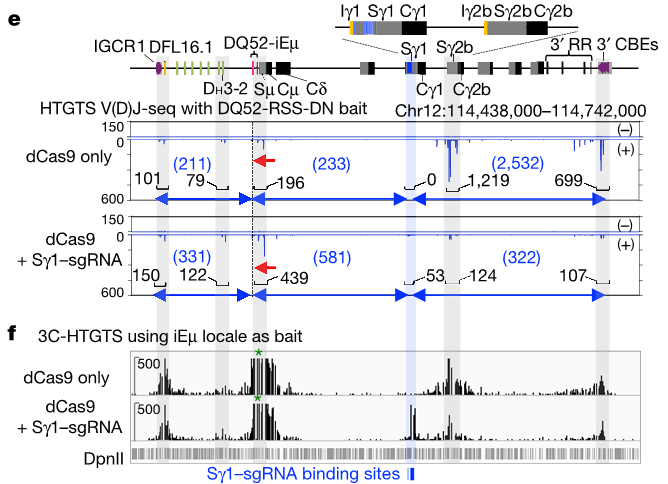
图片来源:nature
这些发现证明,通过黏着蛋白环阻止 DNA 的移动会使重组事件发生偏向,从而有利于针对 DNA 迁移受阻部位附近的 RSS 进行重组。
重要的是,该模型中的定向 DNA 扫描机制还解释了在 V(D)J 重组过程中删除而非倒置事件的优势,这一直是无法解释的难题。
证明了黏着蛋白结合元件(某些抗体 V 基因片段旁边的 DNA 基序)是 DNA 重排模式的主要决定因素。
在第二篇文章中研究人员又对染色质环挤压对抗体类别转换重排(CSR)产生机制的影响进行了深入研究。
研究人员首先使用 anti-CD40 与 IL-4 作为诱导剂在静息 B 细胞中诱导 Iγ1 和 Iε 下游基因的转录。
然后分别借助全局连续测序(global run-on sequencing, GRO-seq)、高通量全基因组易位测序(high-throughput genome-wide translocation sequencing, HTGTS)、染色质免疫沉淀测序(chromatin immunoprecipitation sequencing, ChIP-seq)对其进行研究观察。
同时,为了避免 AID 突变酶引发 CSR 相关的基因组重组,整个实验都在 AID 缺陷型细胞中进行。
实验结果如下图所示:
GRO-seq 结果显示,添加 anti-CD40 与 IL-4 诱导后的 B 细胞相比于静息 B 细胞在 Cγ1 与 Cε 处发生转录。
HTGTS 结果显示,使用 iEμ–Ιμ 与 3′ IgHRR (HS4) 序列分别作为诱饵在诱导后的 B 细胞基因组上与 Cγ1 与 Cε 基因发生互作。
而进一步的 ChIP-seq 也显示,黏着蛋白载体 NIPBL 与黏着蛋白亚基 RAD21 在 Cγ1 与 Cε 进行了积累,推测出黏着蛋白在这两个区域遇到阻碍并停滞。
总体而言,GRO-seq,3C-HTGTS 和 ChIP-seq 研究表明,I 启动子通过 3'IgHRR 进行转录激活的线性竞争是通过环挤压发生的,并且进一步暗示 I 启动子的转录激活会阻碍「基础」3'IgH 亚环内诱导的内部挤压,从而促进 CSR 中心(CSR center, CSRC)中 Sμ 和转录的受体 S 区域的顺式方向对齐。
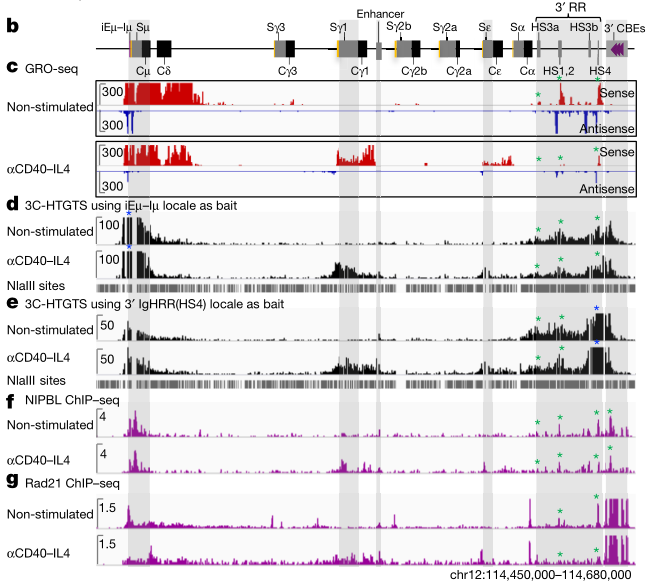
图片来源:nature
紧接着,为了更全面揭示染色质环挤压的动态过程,研究人员又把 CH12F3 B 淋巴细胞作为实验对象(该细胞系只能由 IgM 转换成 IgA),敲除 Iα 后用 Anti-CD40-IL-4-TGFβ 作为诱导物,同样利用 GRO-seq,3C-HTGTS 和 ChIP-seq 等测序技术来评估 Iα 转录在 AID 之外的 SαCSR 中的潜在作用。
研究人员发现,黏着蛋白介导的环挤压促进 3’RR 激活 IgH 恒定区上游转录单位和 Sm-Sx 配对,并揭示了 CH12F3 细胞只进行 IgA 重组的机制。
最后,研究人员又继续探究了 CH12F3NCΔ 细胞中 Sα 和 Sμ 之间插入 CBE 对环挤压介导的 CSR 的影响,i3CBE 对 IαΔCH12F3NCΔ 中环挤压介导的 CSR 的影响。
以上的一系列实验完整地揭示了黏着蛋白介导的染色质环挤压过程是 CSR 发生的重要机制。
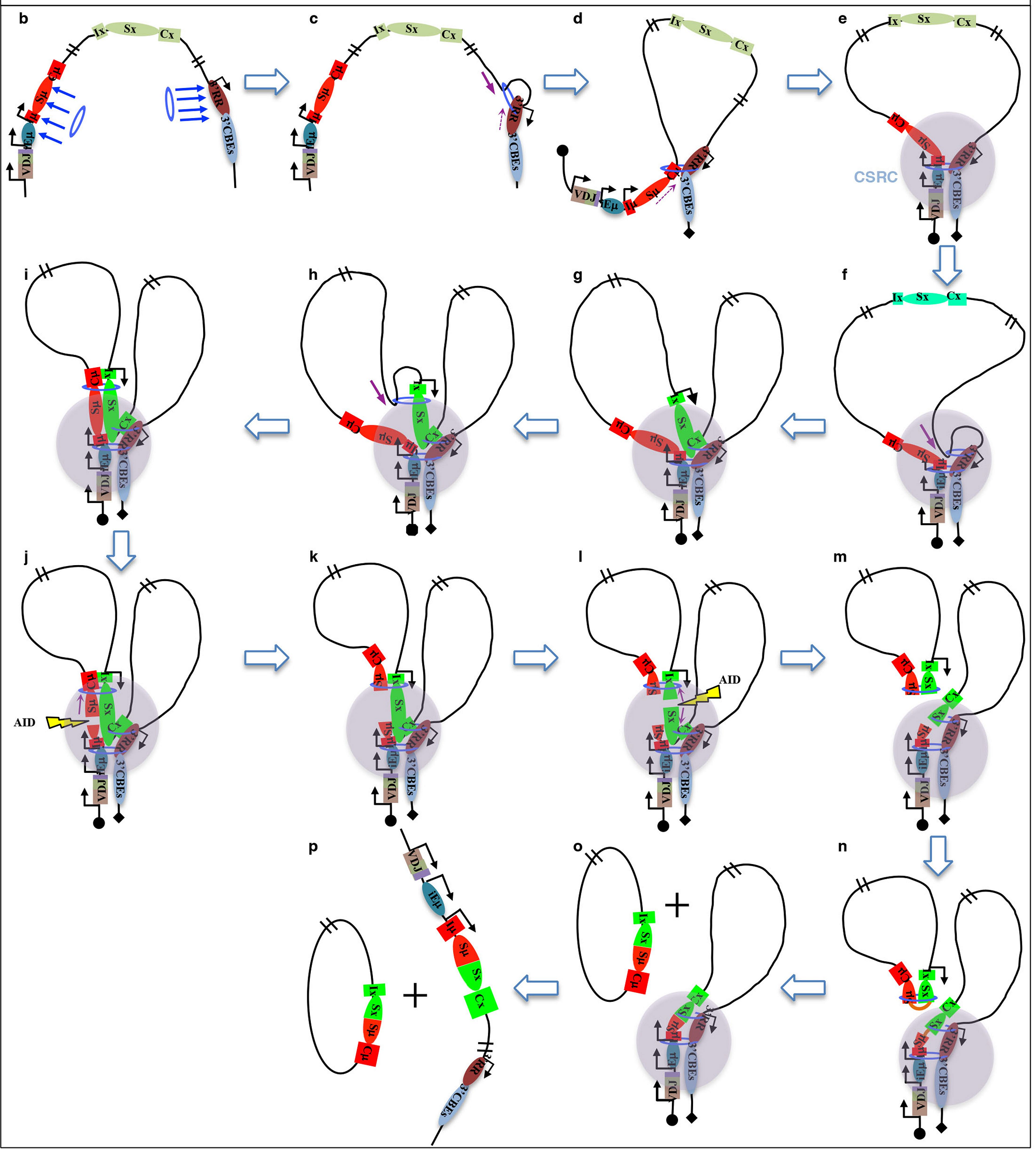
图片来源:nature
以上两篇文章提出的两个模型提供了可待检验的预测,同时也提出了一些问题。例如,如何将粘着素招募到 VDJ 和 CSR 重组中心?
特定细胞谱系中的黏着蛋白耗竭会导致 V(D)J 重组缺陷,黏着蛋白的缺失消除了整个染色体上的所有染色质环。然而,这些改变对 CSR 重组的影响尚待确定。
另外,依赖 DNA 调节基因表达或实现基于重组的免疫多样化可能会驱动一种称为染色体易位的染色体异常,这也可能会导致癌症的发生。
就像 DNA 循环本身一样,这些对染色体结构作用的见解可能有助于揭示先前被认为是分开的区域之间的联系。
参考文献:
1. Zhang, Y. et al. The fundamental role of chromatin loop extrusion in physiological V(D)J recombination. Nature 573, 600-604, doi:10.1038/s41586-019-1547-y (2019).
2. Zhang, X. et al. Fundamental roles of chromatin loop extrusion in antibody class switching. Nature 575, 385-389, doi:10.1038/s41586-019-1723-0 (2019).