新发现!Science 揭示靶向疗法导致癌细胞耐药性产生的根本原因!
基因突变是癌症发生与发展的重要驱动力,肿瘤内部遗传异质性的产生使得癌细胞能够更好地适应环境中的选择压力。
通过对遗传位点进行分析,我们已经找到了对细胞癌化以及癌症进展来讲十分重要的突变类型以及相应蛋白产物的活性瞬时变化特征 1。然而,目前我们并不清楚导致基因组稳定性下降的分子机制。
今天发表在 Science 杂志上的一项研究揭示了靶向表皮生长因子受体(EGFR)或 BRAF 信号的药物会导致结直肠癌(CRC)细胞的基因组稳定性下降以及遗传异质性的升高,从而推动了癌细胞耐药性的产生。

图片来源:Science
研究背景
早在 1943 年,Luria 和 Delbrück 等人发现:细菌对噬菌体产生抵抗力是由于自发的随机突变造成的 2。
因此,人们理所当然的认为癌细胞对药物产生的耐受性也是由药物治疗之前已经存在的「自发突变」所导致的。
基于这一观点,药物治疗后癌症的复发是由于在药物治疗之前该肿瘤组织中已经存在具有耐药性的「亚克隆」。而癌症复发的时间仅仅决定于最初的耐药性亚克隆数量以及其扩增的速度。
然而,微生物领域的研究表明:在有选择压力的情况下,细菌与真菌也会因基因组不稳定而产生新的突变,这一现象被称为「压力诱变」。
压力诱变在正常情况下对个体往往有害,但在外界压力存在时则有利于微生物的存活。
例如,通过降低生长速率,细菌能够在含有抗生素的环境中持久地生存。DNA 错配修复效率的下降以及易错 DNA 聚合酶活性的上升均帮助微生物提高了突变的几率。
从群体角度来看,突变率的上升会提高细菌的遗传多样性,从而能够帮助它们适应复杂的生存条件,而在细菌已经完全适应之后,又会有相应的反向调控机制激活,以防止有害突变的积累 3。
基于对微生物的「生存策略」的进一步了解,我们不禁怀疑:是否癌细胞也有相似的「定向进化特征」呢?
此前研究表明,当使用靶向药物杀伤肿瘤细胞时,通常会观察到耐药性亚群的出现,随着药物治疗的持续,这部分携带耐药性突变的肿瘤细胞亚群最终占据主导地位并使得药物不再有效。
最近的研究表明,携带耐药性突变的肿瘤细胞不仅起源于最初的亚克隆(事实上这部分占比极少),而且也可以来源于因药物刺激而产生的新亚群 4。
随着药物治疗过程中肿瘤细胞的遗传多样性的增高,后者发生的可能性也将大大增加。
因此,在持久性的药物治疗中,肿瘤细胞可能会改变其 DNA 修复和 DNA 复制机制,以增强其遗传多样性及对抗多重风险的能力,这一点或许与单细胞微生物类似。
针对这一假设,来自意大利坎迪奥洛癌症研究所的 Alberto Bardelli 团队研究了结肠癌细胞在受到药物刺激之后的基因组稳定性变化情况,进而揭示了癌细胞的「应激演化策略」5。
主要内容
靶向疗法破坏大肠癌细胞 DNA 错配修复以及同源重组的能力
为了验证这一假设,作者首先使用抗 EGFR(表皮生长因子受体)抗体「西妥昔单抗(CTX)」(西妥昔单抗与 panitumumab 的联合使用被批准用于治疗 RAS 和 BRAF 突变的转移性 CRC 患者),或采用西妥昔单抗联合 BRAF 抑制剂达布拉非尼(DAB)治疗人源大肠癌细胞(DAB 在 BRAF 突变的 CRC 患者中显示出潜在的治疗活性)。
结果表明,对于野生型且对 EGFR 阻断敏感的大肠癌细胞(DiFi)来说,单独 CTX 治疗能够起到显著的杀伤效果(下图左),对于携带 BRAFp.V600E 突变的细胞(WiDr)而言,联合用药也能够起到杀伤效果(下图右)。

图片来源:Science
在开始治疗的几周内,会有少量「抵抗性细胞」的存活,而在去除药物压力之后,细胞开始快速增长,并在群体水平重新恢复对药物的敏感性(下图空心灰框组)。
这些结果表明上述治疗产生的细胞耐受性特征是可逆的。
然而,在接受了较长时间的治疗之后,会有「永久性耐药细胞亚群(下图实心红框组)」的产生,这些细胞在去除环境中的药物压力后并没有重新变得敏感。
以上结果表明,长时间药物刺激会导致细胞产生永久性的耐药特征,也反映了药物刺激与耐药性性状产生之间的潜在的因果关系。
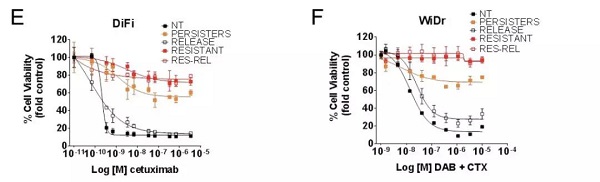
图片来源:Science
之后,作者比较了大肠癌细胞在不同的刺激条件下内部 DNA 修复基因的表达情况。
转录组结果显示:药物刺激会下调与 DNA 突变修复(MMR)相关基因的表达,例如 MLH1, MSH2, MSH6。
同时下降的还有参与同源重组的效应蛋白,包括 BRCA2 和 RAD51。参与 DNA 错配修复以及双链断裂修复(DSB repair)的核算外切酶 EXO1 的表达也受到了影响。

图片来源:Science
为了验证靶向疗法是否影响 CRC 细胞中的 DNA 修复能力,作者使用了基于荧光的多重宿主细胞激活(FM-HCR)分析方法。即,使用含有 G:G 错配的质粒转染 CRC 细胞,以确定药物治疗对后者 MMR 活性的影响。
结果显示,在用靶向药物处理过的 CRC 细胞中,MMR 活性(MMRp)显著降低。
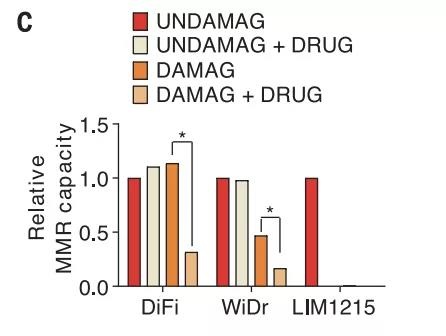
图片来源:Science
接下来,作者通过向 CRC 细胞中转染 pDRGFP /pCBASce-I 分析了 DSB 绿色荧光信号的产生情况。结果表明,靶向药物治疗后,DiFi 细胞和 WiDr 细胞的同源重组能力均明显降低。

图片来源:Science
药物治疗后的残留疾病患者样本中 MMR 活性下调
为了在患者样本中验证上述结果,作者收集了接受药物治疗后的患者肿瘤组织样本,并且分析了不同阶段相关蛋白的表达情况。
结果表明,当癌细胞对药物治疗整体上表现出最高程度的敏感性时,其癌变组织内部 MLH1 以及 MSH2 的表达量相比对照组发生明显下降。
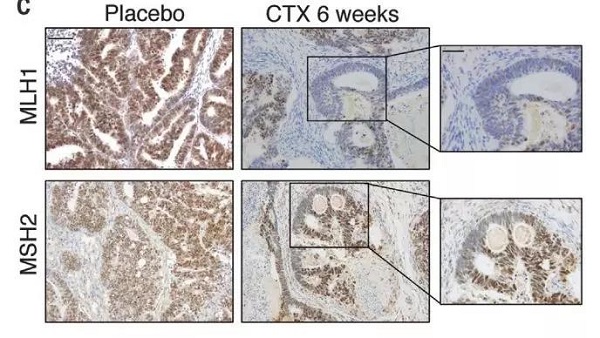
图片来源:Science
基于上述结果,作者希望了解药物治疗是否引发癌细胞内部基因损伤的发生,以及癌细胞内部 DNA 损伤修复错误的发生率是否会升高。
对此,作者对 H2AX193 位丝氨酸的磷酸化(一种指征 DNA 损伤的常见标志物)进行了检测。
结果表明,接受药物治疗之后,细胞核中阳性的比例明显升高,而且存在剂量与时间依赖性(下图)。而在持续性药物治疗后出现永久性耐药性特征的亚群中则没有更多的 DNA 损伤的累积。
此外,作者发现药物治疗后 53BP1 阳性细胞核的数量也明显增高,并同时呈现剂量和时间依赖性(53BP1 促进非同源末端连接介导的 DSB 修复,同时通过限制末端切除来抑制同源重组的发生)。
以上结果表明:靶向药物治疗触发了癌细胞从高保真修复向易错性 DNA 损伤修复的转变,从而潜在地增加了耐药性突变发生的几率。
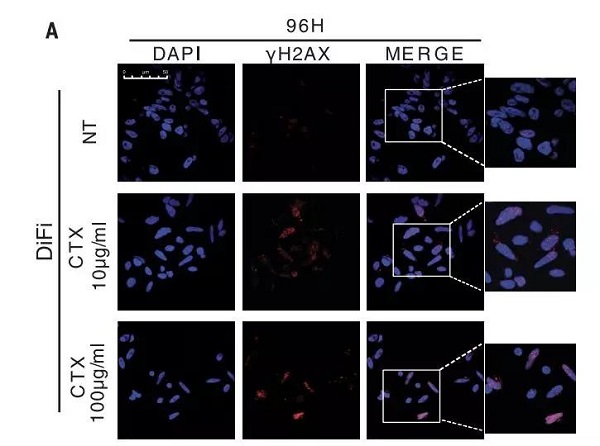
图片来源:Science
之后,作者探究了上述现象发生背后的原因。尽管化疗药物本身可以直接造成 DNA 损伤,但这类靶向药物并没有被证明存在同样的毒性。
不过,此前研究表明 BRAF 抑制剂等药物能够引起细胞 ROS 反应,有可能间接导致 DNA 损伤的发生。
实验结果表明,药物处理确实能够提高癌细胞 ROS 的活性(下图)。然而,在已经产生永久性耐药性的细胞中,则没有 ROS 上升的现象出现。

图片来源:Science
靶向治疗如何触发癌细胞「压力反应」
为了揭示癌细胞诱变的内在机制,作者分别探究了「细胞周期破坏」「DNA 损伤」以及「主动压力反应」等可能。
实验结果表明,细胞周期的干扰或者 DNA 损伤的诱导并不会引发 MMR 或同源重组相关蛋白表达量的下调。
然而,药物刺激能够明显下调 mTOR 的磷酸化程度,而后者同样参与了细胞压力反应的信号调节(下图)。
此外,mTOR 本身并不足以解释癌细胞压力反应的产生,源于 mTOR 活性的抑制并不能够影响 DNA 修复蛋白 H2AX 的表达水平,因此,可能还有别的因子参与了癌细胞的压力反应信号调节过程。

图片来源:Science
靶向疗法导致癌细胞「适应性高突变」的发生
下一步,作者研究了癌细胞压力反应与突变率上升之间的关系,利用一种新型的报告系统,该系统能够检测 DNA 突变,并通过荧光值反映突变率的高低。
之后,作者检测了在药物刺激下 MLH1 缺失癌细胞以及野生型癌细胞内部 DNA 突变率的差异。结果表明,在 MLH1 缺失的情况下,癌细胞 DNA 的突变率显著上升。

图片来源:Science
靶向疗法对癌细胞基因组稳定性的影响
最后,作者比较了产生耐药性前后各癌细胞株的基因组稳定性情况,结果表明:相比对照组细胞,在产生耐药性的细胞株中基因组微卫星区域发生改变的比例明显升高,表明基因组稳定性相应更低。
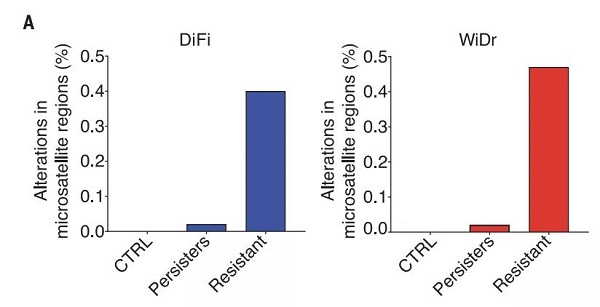
图片来源:Science
讨论与分析
目前癌细胞耐药性的出现是靶向疗法(尤其是靶向 EGFR,BRAF 等)面临的一项极大挑战。
在这项研究中,作者揭示了靶向疗法过程中癌细胞产生的适应性突变的内在机制,将其与 DNA 损伤修复错误率升高,基因组稳定性下降之间建立了联系。
对于单细胞生物来说,外界压力刺激下会导致快速突变的发生,从而快速增加其遗传多样性。这一生物特性有利于物种在遇到不利生存环境时保持群体数量。
从这一角度出发,癌细胞虽然源自于多细胞生物,但其特征与单细胞生物十分相似。
利用这一规律,我们或许可以仿照抗生素的开发思路寻找新的靶向疗法。
在未来的研究中,可以进一步确定每一种靶向疗法中出现的特定突变类型,并从中发现一些规律,这不仅有助于我们对癌细胞适应性突变的理解,而且有助于患者的临床治疗。
扩展阅读
癌细胞演化机制的研究是最近癌症生物学领域十分火热的话题。
本周发表于 Nature 杂志的两篇文章中,来自日本的科学家们从不同角度揭示了溃疡性结肠炎患者其肠上皮细胞在慢性炎症向癌症发展的不同阶段内部突变以及外部组织重塑的特征,进而揭示了在肠炎以及肠癌发展过程中具有关键影响的基因 6,7。
相比本文「药物刺激对癌细胞的影响」,Nature 的两篇文章则重点研究了肠道的炎症环境对正常上皮细胞的基因诱变的影响。
尽管如此,这些研究均强调了外部环境对基因组稳定性以及基因突变的影响。
相关详细解读可戳:基因突变抑制肠癌发生新机制!Nature 背靠背发文揭示肠炎患者上皮细胞定向突变的内在机制。


图片来源:Nature
本篇 Science 原文链接:
https://science.sciencemag.org/content/366/6472/1473
参考文献
1. Alexandrov LB et al. Signatures of mutational processes in human cancer. Nature. 2013 Aug 22;500(7463):415-21.
2. S. E. Luria, M. Delbrück, Mutations of bacteria from virus sensitivity to virus resistance. Genetics 28, 491–511 (1943). pmid:17247100
3. Galhardo RS1, Hastings PJ, Rosenberg SM. Mutation as a stress response and the regulation of evolvability. Crit Rev Biochem Mol Biol. 2007 Sep-Oct;42(5):399-435.
4. Hata AN et al. Tumor cells can follow distinct evolutionary paths to become resistant to epidermal growth factor receptor inhibition. Nat Med. 2016 Mar;22(3):262-9.
5. Russo M. et al. Adaptive mutability of colorectal cancers in response to targeted therapies . Science, . 2019 : 1473-1480
6. Nanki, K., Fujii, M., Shimokawa, M. et al. Somatic inflammatory gene mutations in human ulcerative colitis epithelium . Nature (2019)
7. Kakiuchi, N., Yoshida, K., Uchino, M. et al. Frequent mutations that converge on the NFKBIZ pathway in ulcerative colitis. Nature (2019)









