免疫疗法大升级!迟洪波课题组发现延长 T 细胞存活的关键蛋白
过继性免疫细胞治疗 (Adoptive cell therapy, ACT) 自 1982 年首次被报道以来,迅速成为了肿瘤免疫治疗的主要方法之一。
从一开始的杀伤细胞(lymphokine activated killer cell)到今天通过改造 T 细胞而形成嵌合抗原受体的 T 细胞 (chimeric antigen receptor-engineered T cell, CART),ACT 的应用显著提高了晚期癌症患者的生存概率。
尽管如此,T 细胞在体内存在时间较短以及在实体瘤聚集较少的这一特性,极大的限制了相关技术的进一步发展。
12 月 11 日,来自美国圣犹达儿童研究医院的迟洪波(Hongbo Chi)教授领导团队在 Nature 发表了题为《Targeting REGNASE-1 programs long-lived effector T cells for cancer therapy》的研究 1,发现了通过调节 REGNASE-1 能够显著延长 T 细胞在实体瘤的聚集与体内的存活时间,并进一步揭示了 REGNASE-1 通过调节 BATF 来延长 T 细胞存活时间的机制,与此同时还发现了 PTPN2 和 SOCS1 两个具有协同作用的靶点。该研究有望极大程度地提高相关肿瘤免疫疗法的治疗效果。

图片来源: Nature
研究内容
图片来源: Nature
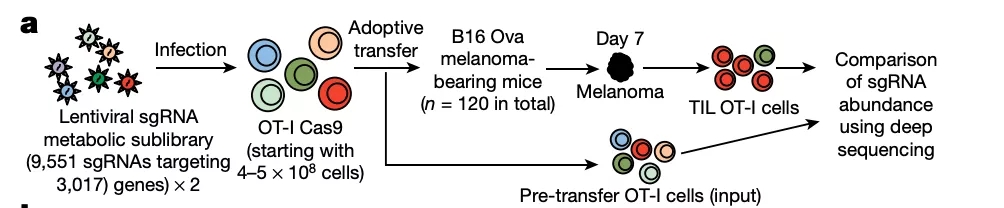
由于此前的研究报道细胞代谢与癌症免疫治疗中的 T 细胞寿命关系密切,研究人员使用 CRISPR–Cas9 诱变筛选技术靶向了 OT-I Τ 细胞中 3017 个代谢相关的基因,在过继到患癌小鼠后,从小鼠的 B16 黑色素瘤中得到肿瘤浸润性淋巴细胞(tumour-infiltrating lymphocytes,TIL)。
图片来源: Nature
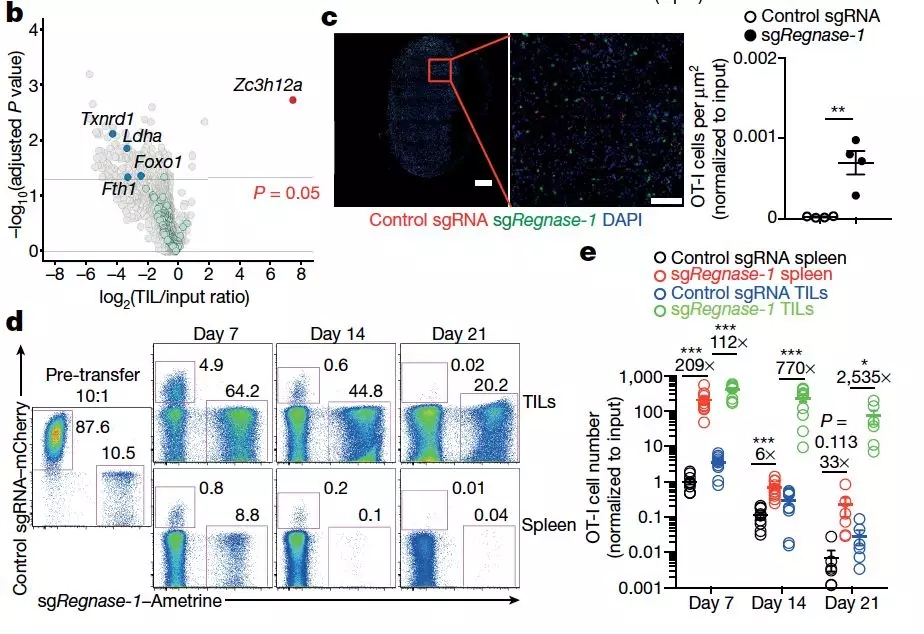
通过分析这些细胞,研究人员在浸润后发现 218 个下调基因,包括此前被报道与 T 细胞寿命与扩增有关的 Txnrd1,Ldha,Fth1 和 Foxo1,同时还发现了 REGNASE-1 在 TIL 中出现最明显的富集。
此前,REGNASE-1 被报道能通过其核糖核酸酶活性激活免疫细胞,但其在 ACT 中的作用依旧未知。
研究人员随后敲除了 REGNASE-1,发现不表达 REGNASE-1 的实验组 OT-I 细胞在脾脏和肿瘤中的数量远高于对照组细胞。
与此同时,野生型 OT-I 细胞在小鼠体内的数量随着时间推移逐渐减少,而 REGNASE-1 敲除的细胞则能长期存在在小鼠体内,意味着 REGNASE-1 的敲除能有效促进 Τ 细胞在肿瘤内的聚集以及提高其持久性。
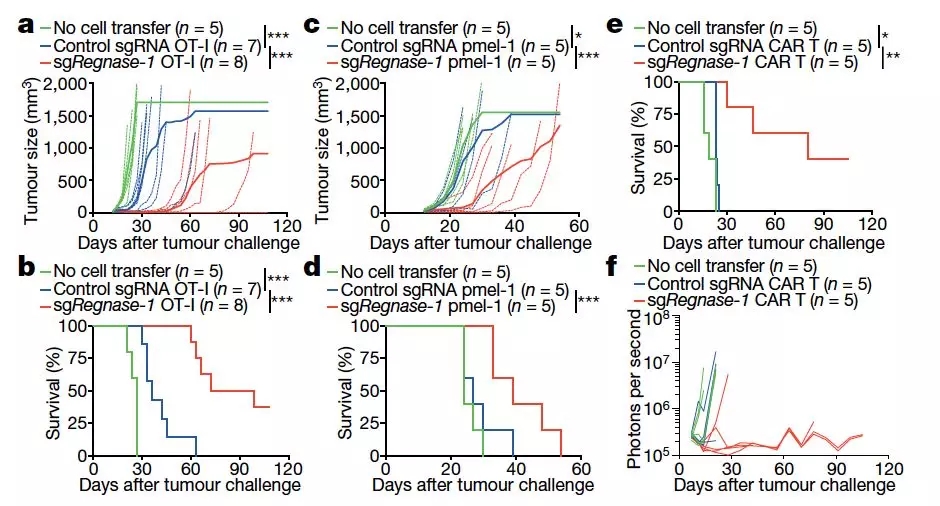
图片来源: Nature
研究人员随后评估了敲除 REGNASE-1 对三种不同的 ACT 肿瘤免疫治疗方法疗效的影响。
发现在敲除后 REGNASE-1 后,小鼠体内黑色素瘤的生长和存活率都出现了明显的改善,而敲除 REGNASE-1 后的 CAR-T 疗法对白血病的治疗效果也出现了显著的提升。
图片来源: Nature
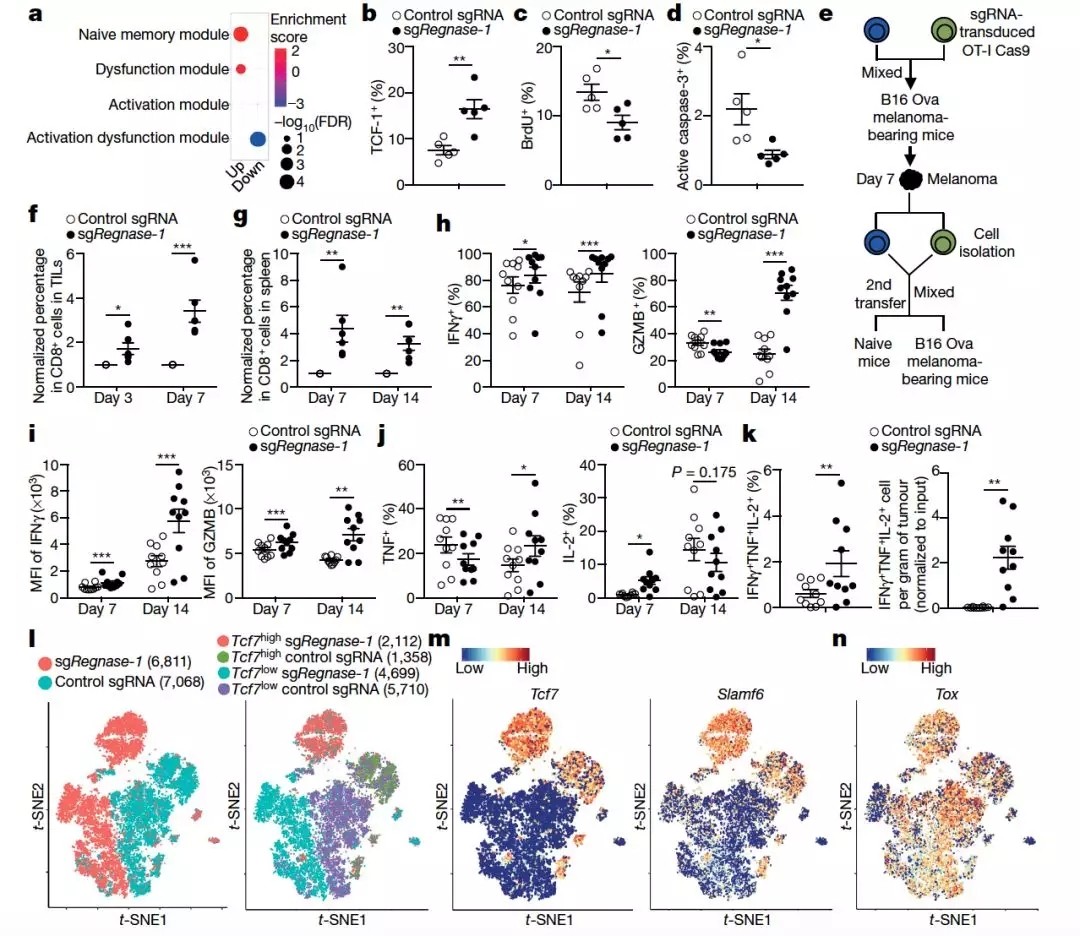
为了进一步探究 REGNASE-1 如何调节 Τ 细胞的存活,研究人员对 REGNASE-1 敲除的细胞做了 RNA-seq,发现肿瘤中初始 / 记忆 T 细胞(naive or memory T cells)的富集。
而与记忆样 CD 8+ T 细胞 (memory-like CD8+ T cells)形成有关的转录因子 TCF-1 也在 REGNASE-1 敲除的细胞中出现了明显的上调。
ATAC-seq 的结果进一步支持了这一观点,说明 REGNASE-1 的敲除在肿瘤微环境中促进 Τ 细胞重编程为初始 / 记忆细胞。
通过分析细胞稳态,研究人员也发现 REGNASE-1 敲除的细胞内的细胞周期信号通路出现了明显的下调,它们的增殖也出现了明显的下降。
但相对的,其细胞死亡和 DNA 损伤也较之对照细胞更少,证明了敲除 REGNASE-1 能降低细胞增殖和提高细胞存活。
尽管 REGNASE-1 敲除的细胞具有记忆细胞的特征,它们同时也具有一些被激活的特征。敲除 REGNASE-1 能在保证细胞存活的同时提高 T 细胞的效应。
一系列免疫因子,包括 IFNγ, granzyme B, TNF 和 ΙL2 在内的免疫因子在 REGNASE-1 敲除后出现了明显的上调。
这些结果证明敲除 REGNASE-1 能够在保证 T 细胞存活的同时维持其抗肿瘤的活性。
图片来源: Nature
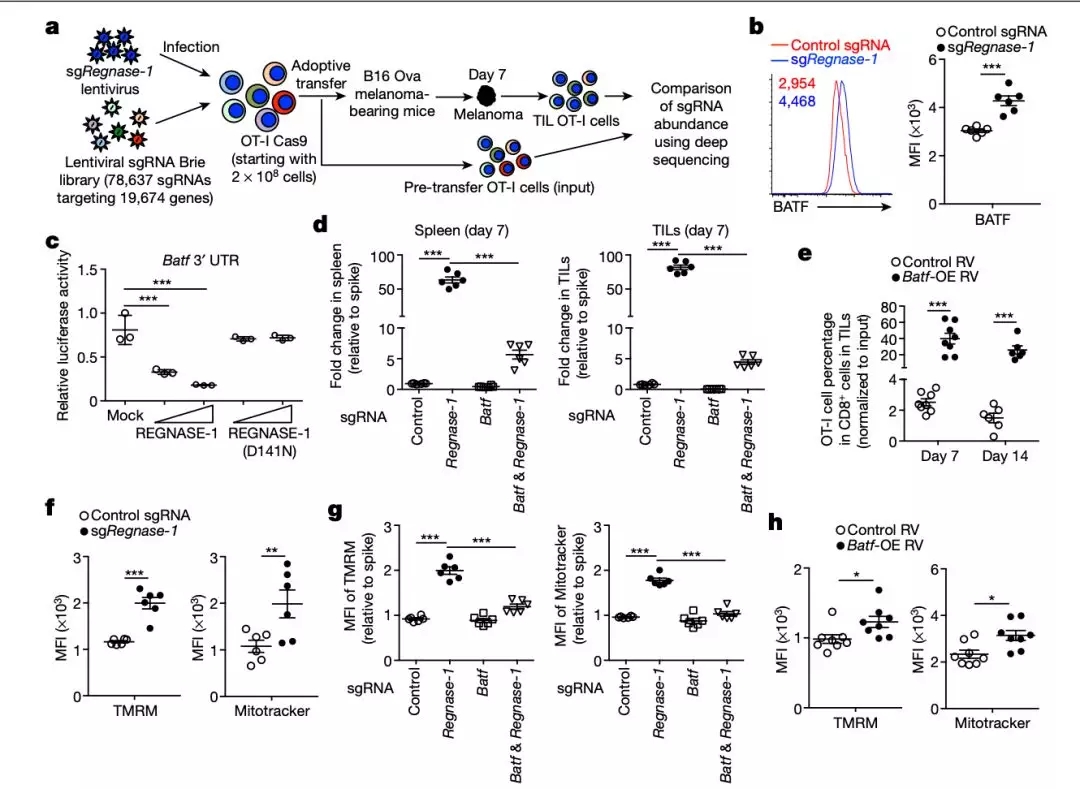
在确认了 REGNASE-1 在细胞层面的作用后,研究人员进行了第二次基因组 CRISPR 筛选,识别出一系列出现了变化的基因。
与之前 RNA-seq 的结果进行比对后,研究人员将目光集中在了 2 个基因上,其中一个就是 BATF。
进一步研究发现 REGNASE-1 能直接降低 BATF 的表达,而敲除 BATF 能显著降低 REGNASE-1 敲除所导致的 OT-I 细胞聚集,TCF1 上调,以及相关免疫因子的增加。
过表达 BATF 则得到了和 REGNASE-1 敲除相似的表型。这些结果证明 BATF 是 REGNASE-1 作用中必不可少的一环。
研究人员还发现 REGNASE-1 通过调节 BATF 来影响线粒体中的氧化磷酸化,说明 REGNASE-1/BATF 能通过改善线粒体功能来调节 T 细胞的存活与效应。

图片来源: Nature
最后,研究人员还探究了进一步增强 REGNASE-1 相关疗法的可能性。
再次使用 CRISPR 筛选,研究人员发现了 Ptpn2 和 Socs1 两个基因,同时敲除 REGNASE-1 和这两个基因能显著增强 REGNASE-1 单敲除的疗效。
而且 Ptpn2 和 Socs1 都与 REGNASE-1 的表达以及线粒体功能无关,也不能影响 REGNASE-1 下游的 BATF 的表达。这些不重合的治疗机制说明了它们与 REGNASE-1 相关疗法联用的可能。
相关研究
迟洪波教授是免疫代谢领域的杰出学者,致力于解析细胞代谢如何影响免疫细胞的功能。
去年,迟洪波教授在 Nature 发文证明了树突状细胞中线粒体能量代谢与其免疫功能之间的纽带 2。

图片来源: Nature
本次研究迟洪波教授也是从代谢相关基因入手,才找到了 REGNASE-1 这一关键性的蛋白,也发现了它在免疫细胞线粒体功能中不同寻常的作用。
而为了提高 CAR-T 疗法和相关肿瘤免疫疗法的疗法,研究人员也致力于打造能在体内持续抗击癌症的 T 细胞。
近年来,科学家开始发现一些潜在的靶点。
在今年 6 月,来自美国宾夕法尼亚大学的 E. John Wherry 教授也在 Nature 发文,报道了靶向 TOX 可以改善 T 细胞耗竭 3。这个研究同本研究一样也有希望显著提高 CAR-T 疗法的疗效。

图片来源: Nature
小结
REGNASE-1 的发现有希望解决包括 CAR-T 在内的过继性免疫细胞治疗多年以来遇到的瓶颈。
此前,限制 T 细胞相关疗法的疗效的主要原因就是 T 细胞在实体瘤的聚集的不足,以及它们存活和功能的持久性,而 REGNASE-1BATF 和其协同基因的出现有可能帮助人类攻克这一难题。
该研究通过大规模使用 CRISPR 筛选,将 REGNASE-1 通路及其复杂的机制展现在大家面前,让免疫细胞疗法有了进一步升级的可能。
参考文献
1. Wei J, Long L, Zheng W, Dhungana Y, Lim SA, Guy C, Wang Y, Wang Y-D, Qian C, Xu B, Kc A, Saravia J, Huang H, Yu J, Doench JG, Geiger TL and Chi H. Targeting REGNASE-1 programs long-lived effector T cells for cancer therapy. Nature. 2019.
2. Du X, Wen J, Wang Y, Karmaus PWF, Khatamian A, Tan H, Li Y, Guy C, Nguyen T-LM, Dhungana Y, Neale G, Peng J, Yu J and Chi H. Hippo/Mst signalling couples metabolic state and immune function of CD8α+ dendritic cells. Nature. 2018;558:141-145.
3. Khan O, Giles JR, McDonald S, Manne S, Ngiow SF, Patel KP, Werner MT, Huang AC, Alexander KA, Wu JE, Attanasio J, Yan P, George SM, Bengsch B, Staupe RP, Donahue G, Xu W, Amaravadi RK, Xu X, Karakousis GC, Mitchell TC, Schuchter LM, Kaye J, Berger SL and Wherry EJ. TOX transcriptionally and epigenetically programs CD8+ T cell exhaustion. Nature. 2019;571:211-218.
原文链接:https://www.nature.com/articles/s41586-019-1821-z