伟大的期望:结构生物学,大分子机器和移动的目标
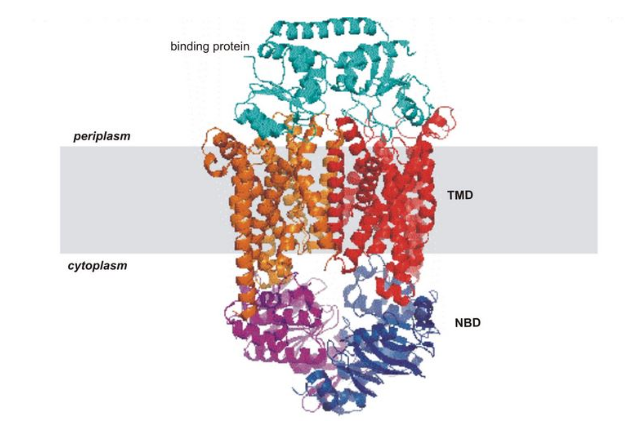
近年来的技术发展使得对复杂或动态大分子系统的理解有了巨大的进步,这已经不是什么新闻了。但正如戴维•斯图尔特(David Stuart)最近在利兹举行的阿斯特伯里首演(Astbury Conversation)中所言,巨大的进步相应地带来了巨大的期望。以下是对这些期望是如何实现的有选择性的叙述,反映在专题讨论会上的谈话中。
病毒、疫苗和药物靶标
戴维·斯图亚特在小核糖核酸病毒是在他的工作——人类和动物疾病的原因,也许最臭名昭著的脊髓灰质炎和手足口病和提供疫苗和抗病毒药物的目标基础上的结构特点和要求的理解病毒病原体——他的实验室的长期目标。
面对同样的挑战,Peter Stockley展示了低温电子显微镜对病毒包装问题的影响。病毒衣壳特别围绕病毒RNA组装,使用低温电子显微镜和一系列其他技术,他已经能够识别提供这种特异性的信号,并展示它们是如何做到这一点的,这是为了寻找新的药物靶点。
更好的在一起
彼得Stockley的工作仅仅是一个例子的会议的主题,如何结合各种生物物理方法——NMR数据集,晶体学、质谱分析、分子动力学、光和电子显微镜——做自己不是故事的全部可以使数据不完整,可能相互矛盾的信息。
举例来说,直到plspeaker Michael Levitt所描述的工作之前,在TriC伴侣蛋白中亚基的排序一直是一个悬而未决的问题,因为相对低分辨率的质谱数据和晶体结构给出了不同的答案。
他利用这些数据来进行分子动力学模拟,结果显示亚基的排列顺序与这些低分辨率数据显示的不同,并提供了更好的结构分辨率。
他和他的同事们通过他们的工作发现的结构不对称性也有助于解开蛋白质的机制,这表明类似的亚基可以发挥不同的作用:一些被“微裂”以结合底物进行折叠,而另一些则主要作为atp酶。
在一个更明显的转译应用中,Erin Cutts谈到了如何将显微技术和分子动力学方法相结合,从而有可能为感染疟原虫的一个主要危险因素提出一种分子机制。
在疟疾中,与knob相关的蛋白KAHRP是红细胞“knob”形成所必需的。这些“旋钮”导致了内皮细胞的粘附,防止受感染的红细胞和它们的乘客一起被扫入脾脏进行清除,并涉及到KAHRP与其他寄生虫蛋白和红细胞蛋白谱素的相互作用。
通过应用计算和显微镜艾琳·卡茨和他的同事们已经能够显示表面的正电荷的K2域蛋白质将它附加到血影蛋白和细胞骨架,以及这如何导致这些adhesion-causing突起螺旋结构的中心。
移动的目标
旋钮复合体中蛋白质的特性之一使它们成为一个挑战,因为它们含有大量结构混乱的区域,这是当前研究的热点,传统上很难分析。
通过分子动力学模拟技术和核磁共振波谱技术的发展,这些蛋白质和具有类似难以捉摸的性质的蛋白质,如折叠中间体,已经变得触手可及。
例如,阿斯特伯里中心主任希娜•雷德福描述了她对淀粉样蛋白形成机制及其细胞毒性的一些研究。她展示了新的NMR技术如何捕捉b2微球蛋白的瞬时折叠中间体,可以解释为什么一些变体形式的蛋白质是淀粉样蛋白,以及六聚体可以形成和破坏细胞膜。
NMR波谱历来受到蛋白质大小的限制,大的复合物无法提供信息的光谱,但刘易斯·凯(Lewis Kay)用一种不同的方式证明了这一点,他在NMR蛋白酶体复合物的调节中展示了变构,因此对NMR蛋白酶体复合物“几乎不可见”。
由特定标签的一个子集氨基酸的复杂,核磁共振光谱可以生成显示这些残留的化学环境复杂变化的一个亚基根据其他单元的存在,表明一定程度的变构调节,帮助理解这个至关重要的细胞机制的机制。
NMR更容易用于目标蛋白质大小光谱的另一端,及其动力学随着时间的推移,和阿Cassaignau这些优势有效地用于一项新策略来研究新生的搞笑的折叠过程域与小,直接从核糖体isotopically标记片段。
她表明,化学签名Ig FLN5领域出现的折叠后从核糖体蛋白的大量出现,表明折叠期间抑制翻译为了避免包膜,还发现了一些新生的链和核糖体的表面之间的相互作用可能是部分原因。
“懒惰的选择”
迈克尔•莱维特(Michael Levitt)在他的全会讲话中称,他选择物理学作为“懒惰的选择”,只需要理解原理和运用数学,而不需要记住路径、化学物质和事实。
生物物理学被认为是这两个世界中最糟糕的,因为它既需要对热力学和动力学原理的复杂理解,也需要对蛋白质及其结构域之间的相互作用以及它们与生理学之间的关系有深入的了解。但回报是巨大的。