同源重组为何物?原来克隆可以这样简单!
生物学霸
随着技术发展,小编最近才接触到同源重组克隆技术,只能感叹:生不逢时啊!想起以前在实验室做克隆就觉得非常心累,那时候都使用酶切连接的方法,连一个片段至少要花一个星期,如果同时连接多个片段,花费两个月都不一定能成功。
传统的酶切连接方法和同源重组克隆技术有什么区别?
传统的酶切连接方法是用相同的限制性内切酶消化质粒和含有目的片段的 DNA,得到具有相同的粘性末端或平末端的线性 DNA,对酶切产物进行纯化后,再利用 DNA 连接酶将片段连入载体,得到重组质粒,将重组质粒转入感受态细胞中,进行后续的筛选、扩增。
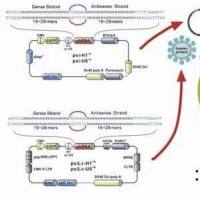
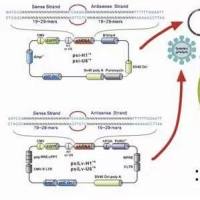
而同源重组克隆技术通过同源重组酶将两个具有相同末端序列的线性化载体和插入片段重组成重组质粒,然后转入感受态细胞中进行筛选、扩增。
与酶切连接方法相比,同源重组克隆技术有哪些优势?
酶切连接方法应用的时间长,技术成熟,但是也有诸多的限制。因为传统的酶切连接实验在开始之前需要分析载体及插入片段上的酶切位点,选择在载体上出现的酶切位点而在插入片段中没有的酶切位点作为限制性酶切割的位点,如果目的片段中也有我们选择的那个酶切位点,酶切的时候就会将片段从中间切开。
在实验中,有时会发现可用的酶切位点很少,甚至只有一个酶切位点可用。而单酶切有弊端,首先,单酶切处理载体,不太容易切开,会有很多环状质粒残留;其次,单酶切的载体在连接片段时不能保证片段插入的方向性;最后,单酶切的载体在重组时很容易发生自连,从而导致高背景。为了防止自连,我们可能会选择用碱性磷酸酶处理单酶切产物,消化掉 5 端的磷酸基团,使载体自身不能自连,但是这一步骤后还要进行纯化,耗费时间,而且去磷酸化的效率比较低,所以仍旧会有大量的载体自连。
有时也会遇到没有任何可用的酶切位点的情况,这时酶切连接的方法就用不了了。对于多片段克隆,使用酶切连接方法将耗费更多的时间。
而同源重组克隆技术能够完美的解决以上问题。
第一,同源重组克隆技术在制备片段时并不需要酶切消化,因此也就无需考虑片段上的酶切位点。
第二,对于线性化载体的获得除了通过酶切的方法,还可以通过反向 PCR 的方法,不受酶切位点的限制,也就是说载体上的插入位点可以任意选。
第三,对于单酶切获得的线性化载体,也不需要担心同源重组时发生载体自连的情况。因为同源重组酶中没有连接酶,所以单酶切切开的载体不会发生自连,也就不需要用碱性磷酸酶进行处理。
第四,同源重组发生在片段和载体末端同源的序列上,因此片段插入方向是固定的。
第五,对于载体上没有酶切位点的情况,我们可以使用反向 PCR 的方法来获得线性化载体,在 PCR 扩增插入片段时,在片段两端加上与载体末端同源的序列即可。
第六,对于多片段克隆,同源重组克隆技术可以一步实现多至 5 个片段的载体构建,简单省时!