PNAS:曹雪涛院士团队发现 LncRNA 调控抗病毒天然免疫和自身免疫病的新机制
作为抵抗病毒感染的第一道防线,I 型干扰素(IFN-I,包括 IFN-α 和 IFN-β)通过激活数百种 IFN 刺激基因(ISG)的表达而发挥着核心作用。干扰素产生不足会导致慢性病毒感染,而过量的干扰素则会导致自身免疫炎症和 I 型干扰素病。因此,在时间和空间维度上精确调控 IFN 的产生,从而确保诱导出针对病毒感染的有效天然免疫反应,同时避免自身免疫性疾病的发生是至关重要的。探究清楚其中精细的调控机制,对于抗病毒和自身免疫病的治疗都具有重要意义。图片来源:Janeway's Immunobiology 9th Edition2020 年 9 月 9 日,医学科学院北京协和医学院曹雪涛院士、姜明红教授团队在 PNAS 上在线发表了题为 LncRNA Malat1 inhibition of TDP43 cleavage suppresses IRF3-initiated antiviral innate immunity 的研究成果。该研究发现发现核 lncRNA Malat1 抑制 I 型干扰素的产生,从而降低抗病毒能力并抑制自身免疫性疾病的进展。
研究内容
分子筛选:核 lncRNA Malat1 参与天然免疫抗病毒反应的调控
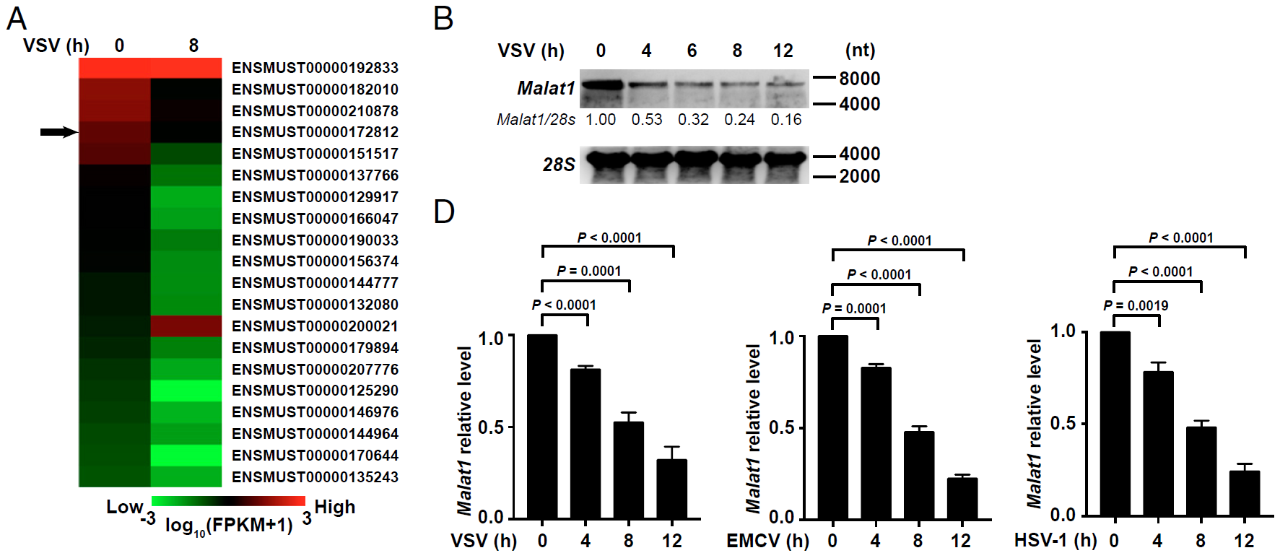
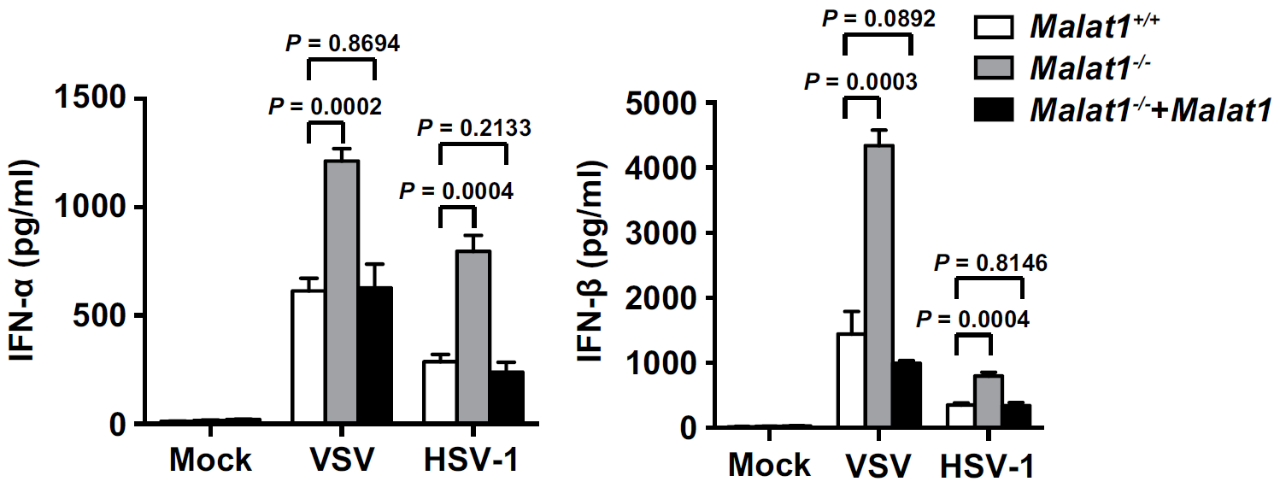
作者首先分离了有或没有水泡性口炎病毒(VSV)感染的 RAW264.7 细胞的核 RNA,通过 RNA 测序(RNA- seq)技术分析核 lncRNA 的表达谱。进一步的实验验证发现,敲低 lncRNA Malat1 的表达可强烈减少 VSV 感染 12 h 后巨噬细胞中的病毒复制。此外,Malat1 是未感染细胞中表达第四多的 lncRNA,VSV 感染后其表达显着降低,提示 Malat1 可能参与天然免疫抗病毒反应的调节。进一步地,作者构建了 Malat1 敲除的巨噬细胞模型,发现 I 型干扰素 IFN-α 和 IFN-β 的表达显著升高,而炎性细胞因子 TNF-α 和 IL-6 的表达变化并不显著。为了研究 Malat1 是否会影响 IFN 介导的抗病毒功能,作者用 IFN-α 或 IFN-β 处理了 Malat1+/+ 和 Malat1-/- 细胞,发现 IFN 介导的抗病毒反应并未受到影响。因此,Malat1 在病毒感染后选择性抑制 IFN-I 的产生,但不影响 IFN-I 的抗病毒功能。机制探究:lncRNA Malat1 是如何影响 IFN-I 表达的?为了分析 Malat1 抑制 I 型 IFN 产生的机制,作者通过 RNA 纯化分离染色质(ChIRP)试验联合质谱分析来确定细胞核中的 Malat1 结合的蛋白。然后,作者使用 siRNA 高内涵筛选技术筛选了这些蛋白在抗病毒天然免疫应答中的功能,发现敲低 TDP43 可以增强巨噬细胞中的病毒复制。进一步的实验证实,结合 Malat1 的 TDP43 选择性地促进 I 型 IFN 的表达以响应病毒感染。
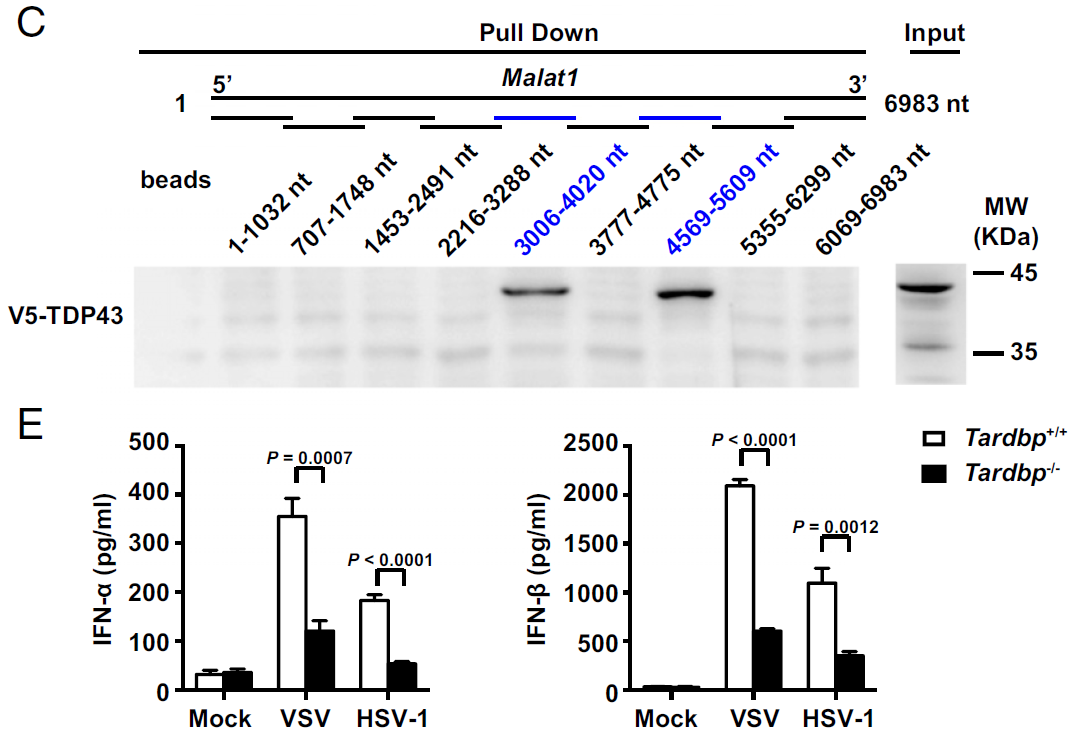
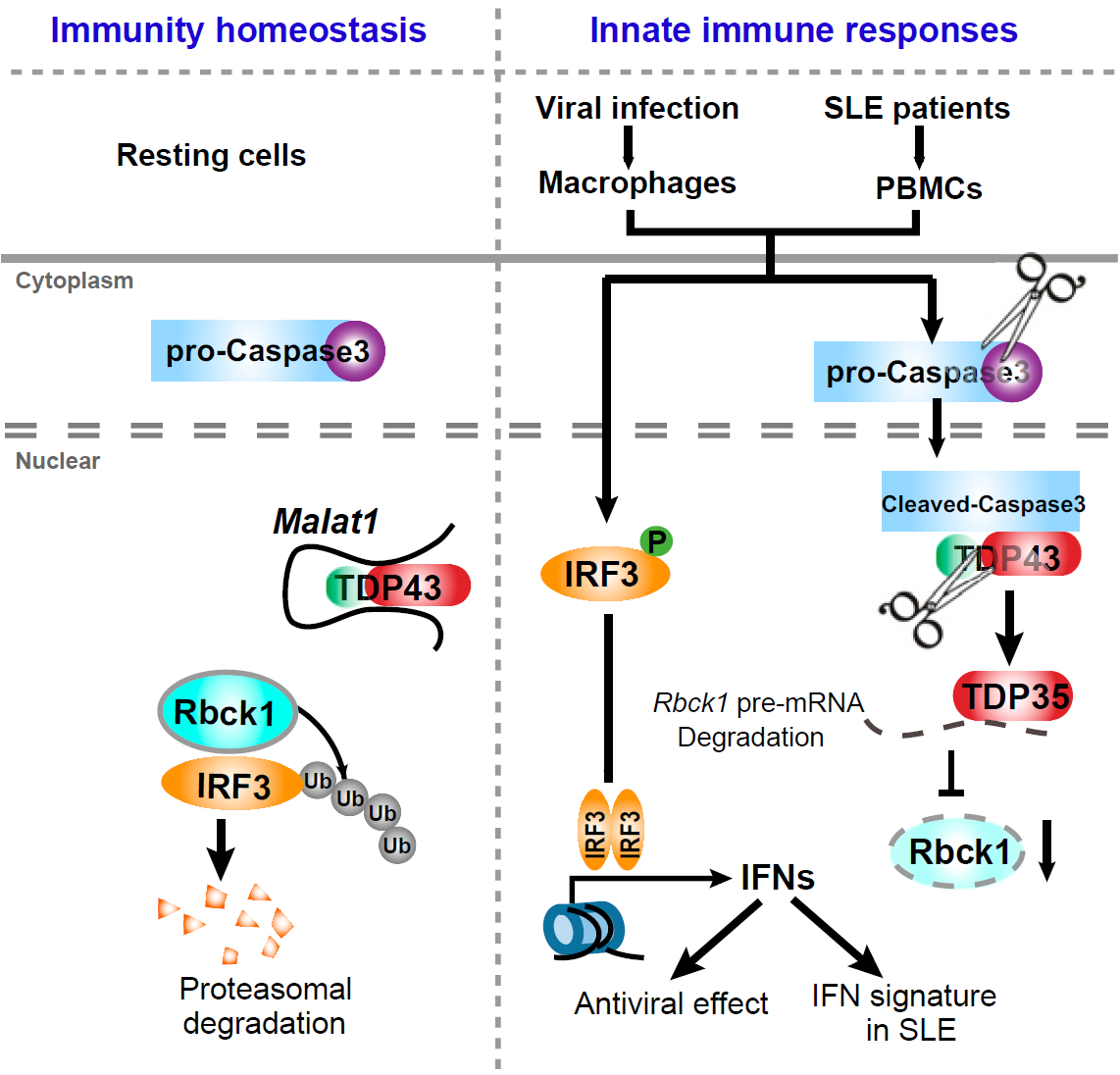
接下来,作者研究了 Malat1 如何通过与 TDP43 结合来抑制 I 型 IFN 的产生。据报道,TDP43 在凋亡过程中主要被活化的 caspase-3 裂解为 TDP35,作者发现在 VSV 感染后的细胞中,敲除 Malat1 后裂解的 TDP43 数量显著增加。在 TDP43 敲除的细胞中回转 TDP35,发现 Ifna 和 Ifnb 的表达都显著升高,提示 TDP35 是 TDP43 促进 I 型 IFN 产生的关键亚基。突变 TDP43 的 caspase-3 切割基序(TDP43D89E)后,其促进 I 型 IFN 产生的作用消失。免疫共沉淀试验发现 Malat1 抑制活化的 caspase-3 与 TDP43 的相互作用,表明病毒感染后 Malat1 通过抑制活化的 caspase-3 介导的 TDP43 到 TDP35 的裂解来抑制 I 型 IFN 的产生。那么 TDP35 又是如何促进 I 型 IFN 产生的呢?鉴于 TDP43 作为 RNA 结合蛋白可参与不同的 RNA 过程(包括可变剪接,mRNA 稳定性和转录调控),作者发现 TDP35 可显著影响 IRF3 的水平,但其并不会直接结合 IRF3 的 mRNA。因此,作者又进一步探究了 TDP35 是否直接靶向与 IRF3 蛋白降解相关基因的 mRNA,RNA pull-down 实验发现 Rbck1 pre-mRNA 的内含子 7 可以与 TDP35 相互作用。在敲除 TDP43 后,Rbck1 的 pre-mRNA 和 mRNA 显著升高。这些结果表明 TDP35 直接调节 Rbck1 pre-mRNA 的稳定性。
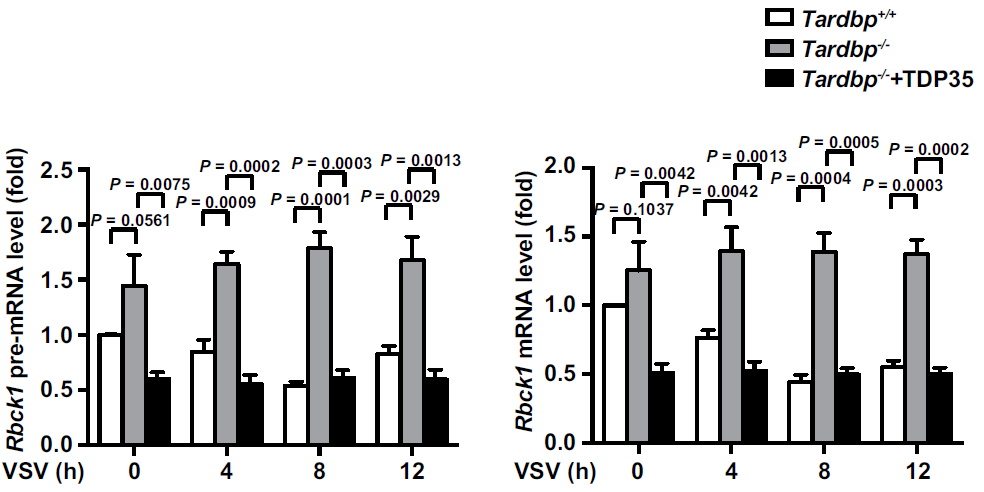
最后,作者发现在病毒感染的巨噬细胞中,Rbck1 充当靶向 IRF3 的 E3 泛素连接酶来介导其降解。临床衔接:系统性红斑狼疮 SLE 病人中是怎样的情况?
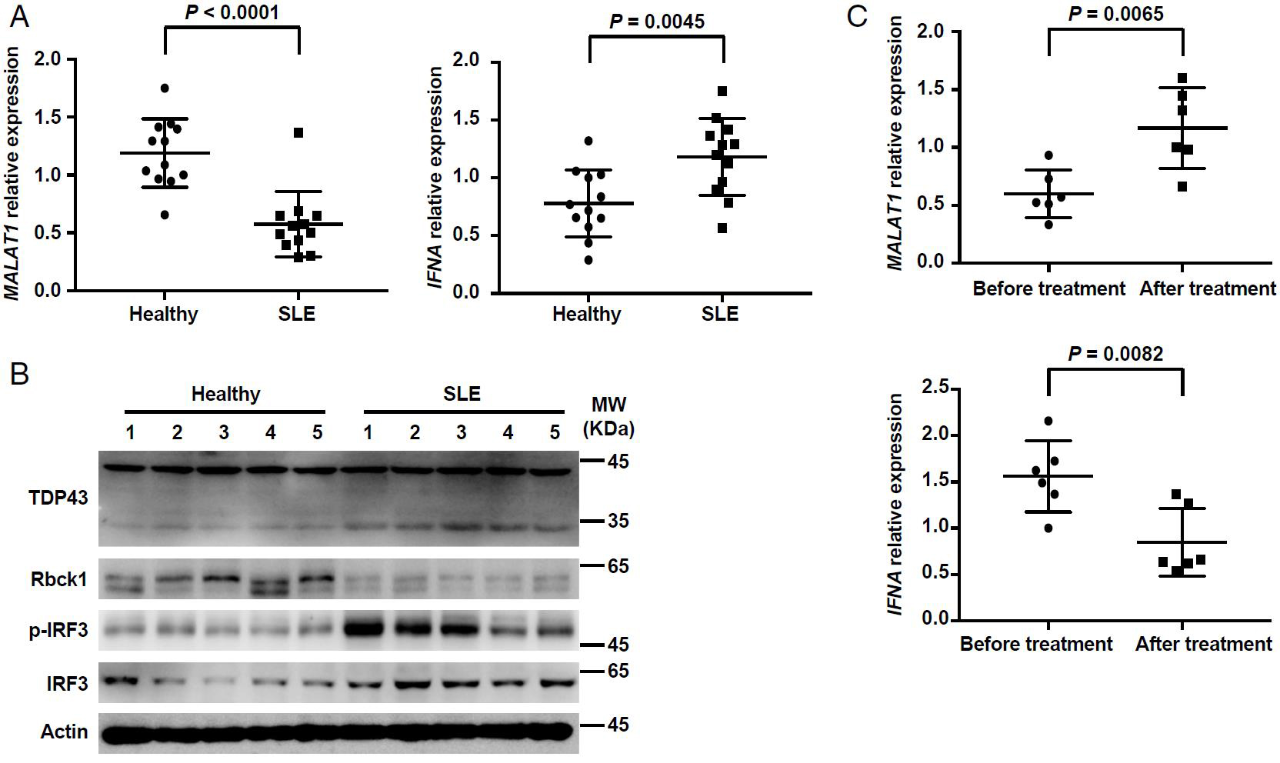
天然免疫应答的失调在许多自身免疫性疾病的发展中起关键作用。系统性红斑狼疮(SLE)是一种常见且可能致命的自身免疫性疾病,其特征是自身抗体的产生和 I 型 IFN 的高表达。作者发现与 SLE 患者的外周血单个核细胞(PBMC)中的 MALAT1 表达显著降低,而 IFNA mRNA 水平显着升高。此外,在 SLE 患者的 PBMCs 中,作者还观察到 TDP43 裂解增加、Rbck1 减少、IRF3 和 p-IRF3 增强。在使用 SLE 的标准治疗药物后,这些分子的水平也受到了显著影响。
研究总结
在本研究中,作者发现病毒感染诱导的 Malat1 减少可促进 IRF3 激活和 I 型 IFN 产生。在静止细胞中,Malat1 与 TDP43 结合,抑制 IRF3 诱导的 IFNs 表达,以维持免疫稳态。病毒感染后,Malat1 表达降低,没有 Malat1 的结合后,TDP43 被激活的 caspase-3 裂解为 TDP35。然后,裂解的 TDP35 通过降解 Rbck1 pre-mRNA 来抑制其泛素化作用,从而增加核 IRF3 的水平,进而增加 IFN 的产生以发挥抗病毒作用。
此外,从 MALAT1 减少到 IFN 产生的这一系列的分子事件在 SLE 患者的 PBMC 中也自发地存在。本研究揭示了 lncRNA 与 I 型干扰素之间的病理生理联系,这使我们能够深入了解自身免疫性疾病的治疗靶点和疾病生物标志物,从而为临床治疗提供新的依据。 ![]()