Circulation:华科协和医院程翔等报道组织特异性Treg 为基础的心脏免疫治疗新思路
心肌梗死是最常见的心血管疾病之一,其主要死亡原因是心室破裂和心力衰竭。因此,在早期和晚期分别预防心脏破裂和控制心室重构可以有效提高临床预后。研究表明,多种免疫成分,包括 Tregs,能够参与心肌梗死后的修复。研究表明,Tregs 可通过减轻局部炎症、保护心肌细胞免于凋亡、调节巨噬细胞分化和肌成纤维细胞活化等途径在心肌梗死中发挥保护作用。调节性 T 细胞 (Tregs),特别是 CD4+Foxp3+Tregs 细胞,在维持机体免疫稳态和调控炎症疾病进展中起着至关重要的作用。Tregs 可以调节多种免疫细胞的激活和功能,包括先天免疫和适应性免疫系统。最新的研究表明,某些组织局部存在的 Tregs——「组织 Tregs」,可直接作用于实质细胞,维持组织稳态。然而,心脏是否存在组织 Tregs 以及其可能发挥的作用是什么,在很大程度上仍不明确。不过,参与心肌梗死的 Tregs 是否具有独特的局部适应性特征,是否在心脏中具有独特的功能,以及 Tregs 群体是如何在心肌梗死心脏中积累的,是什么因素推动了它们的积累,这些几乎都是未知的。
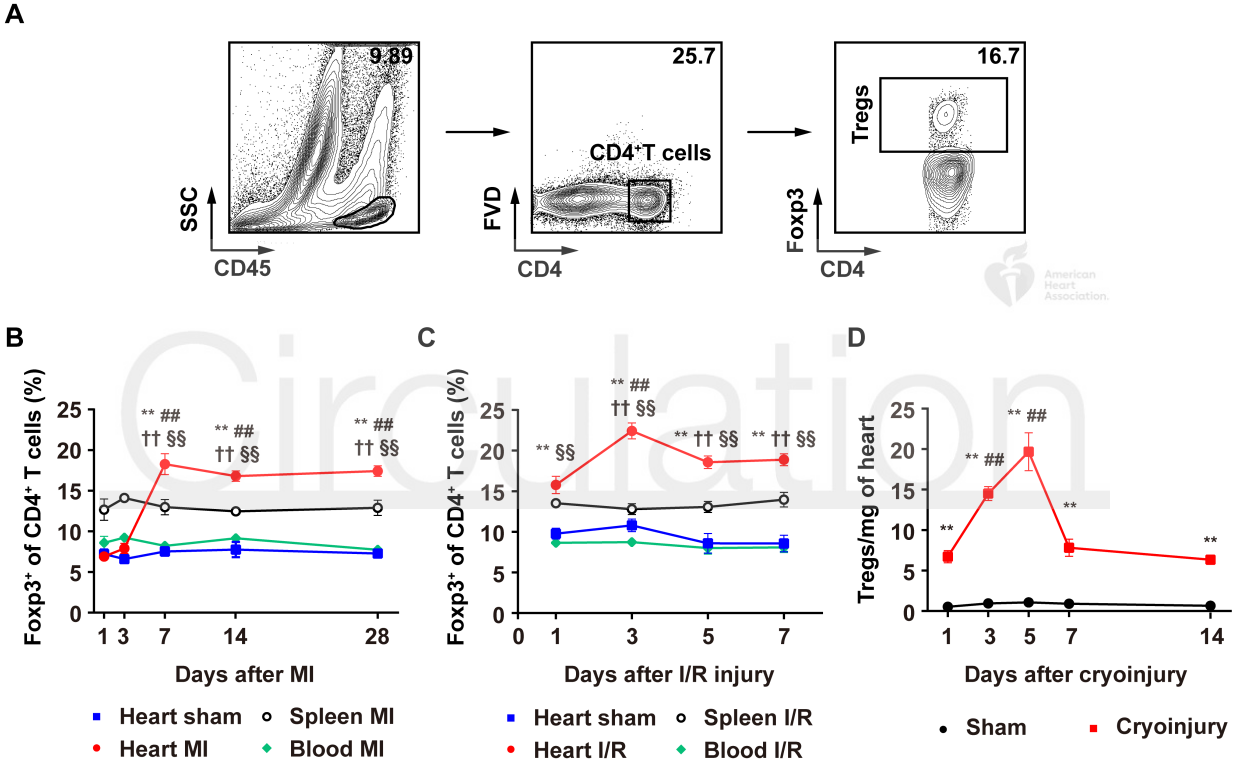
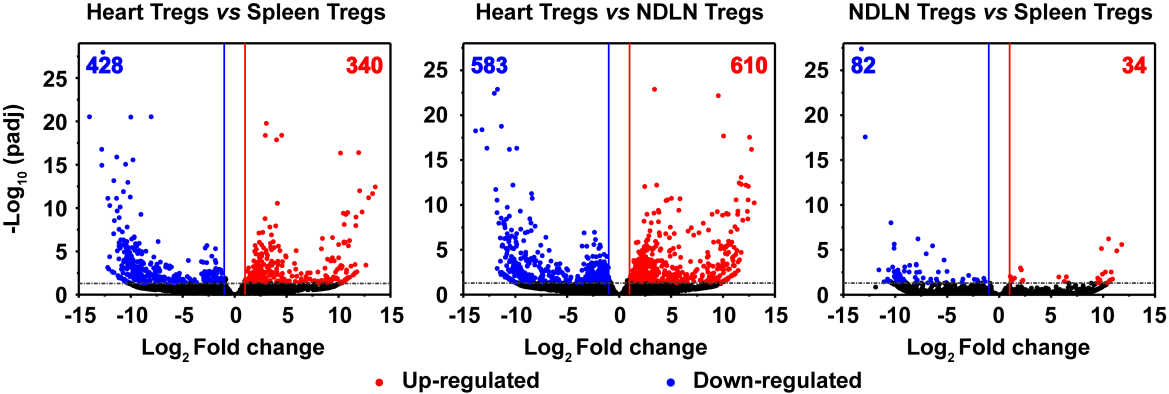
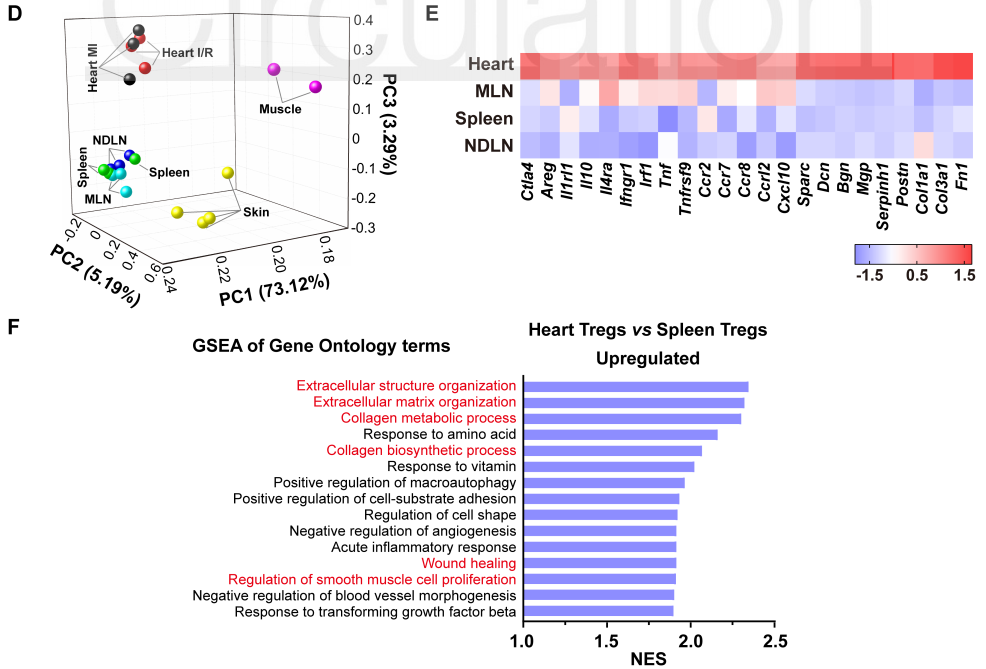
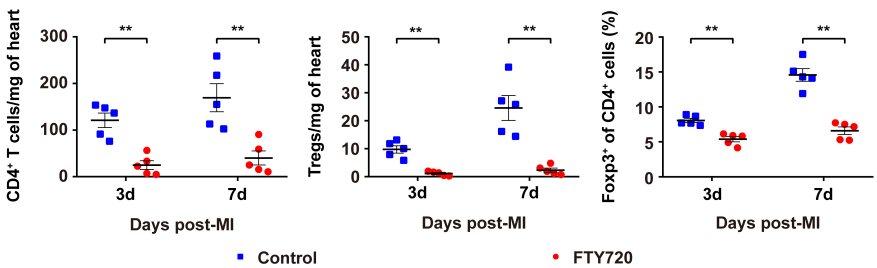
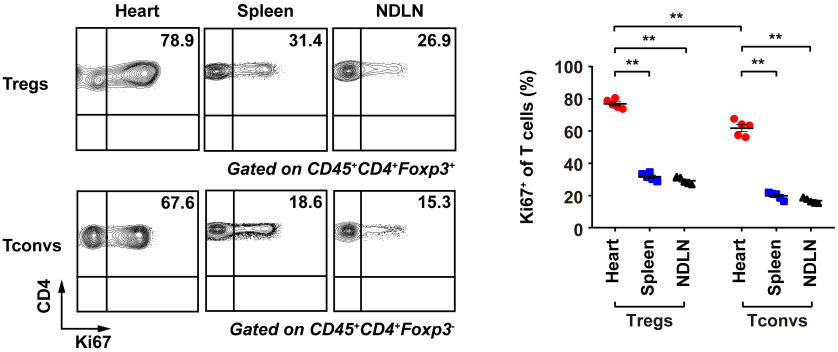
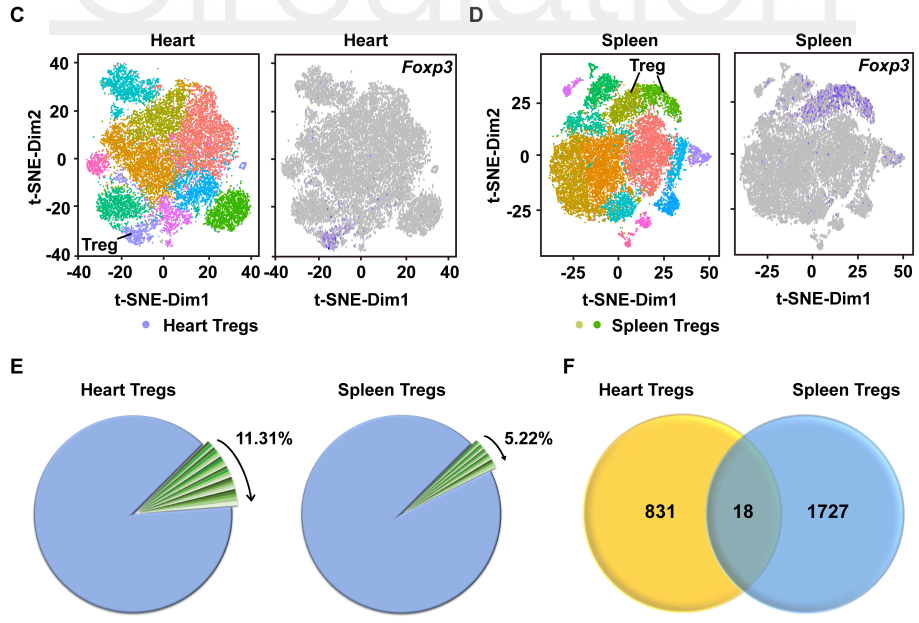
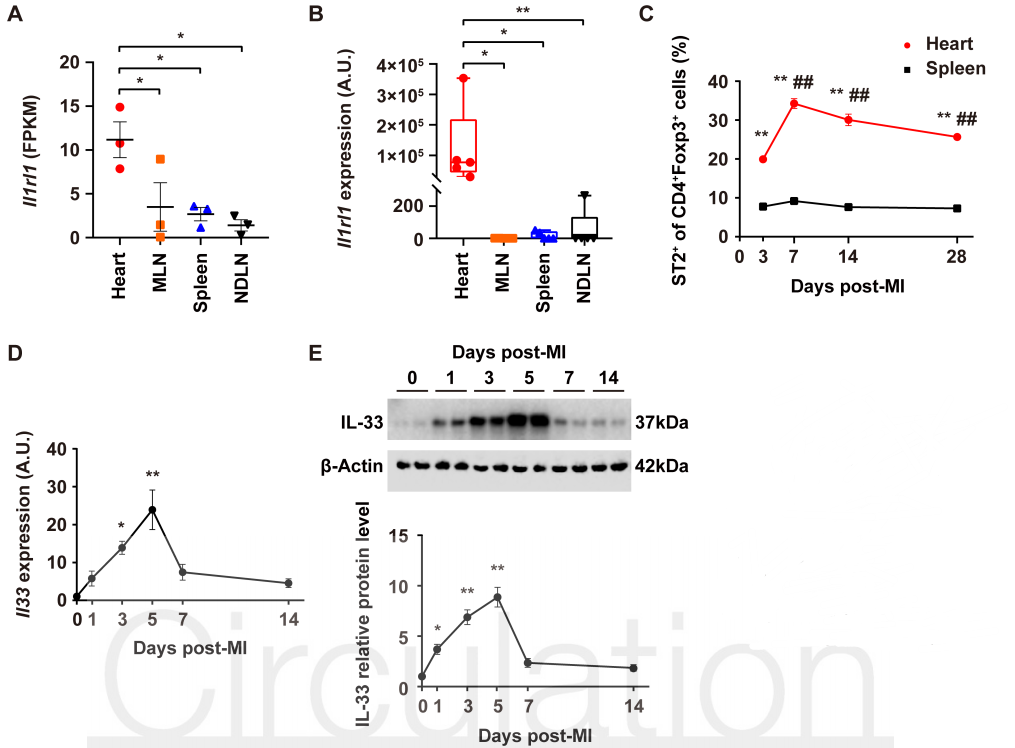
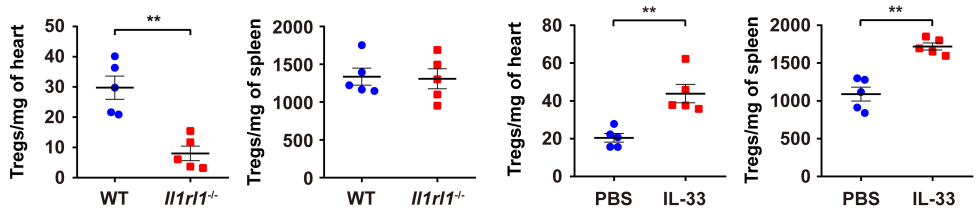
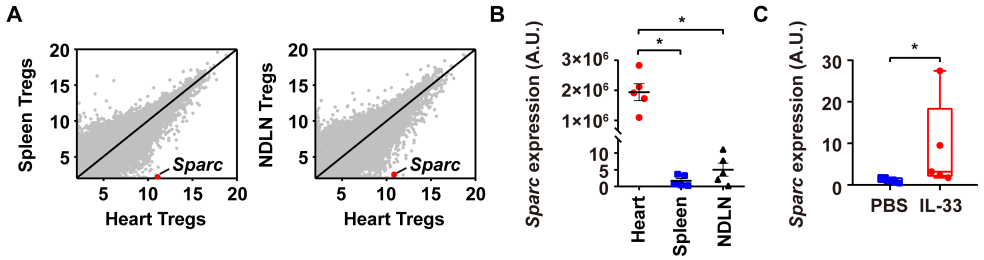
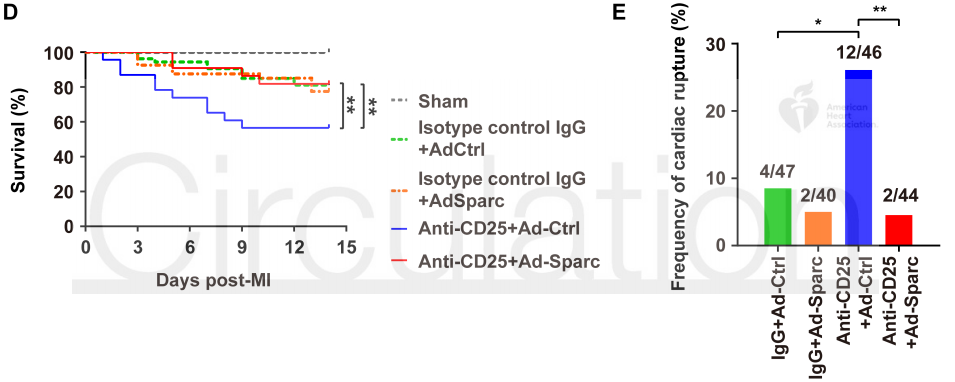
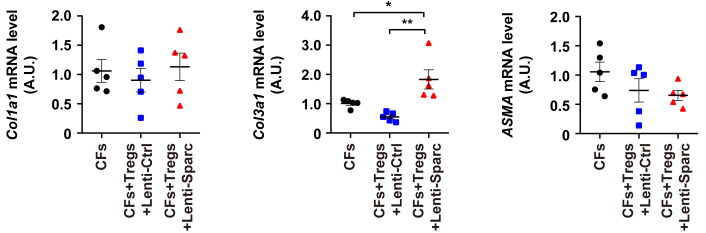
2020 年 9 月 28 日,华中科技大学同济医学院附属协和医院心血管内科程翔教授团队在国际心血管领域顶级期刊 Circulation 在线发表了题为 A unique population of regulatory T cells in heart potentiates cardiac protection from myocardial infarction 的研究性论文。研究发现,心肌梗死后心脏中有一个独特的组织相关 Tregs 群体,它们具有独特的表型、来源和维持因子,并在心脏修复中发挥重要作用,为临床应用 Tregs 治疗心肌梗死提供了新的思路。首先,研究人员分析心肌梗死后心脏 Tregs 在不同时间的浸润情况。结果发现,心脏 Tregs 在心肌梗死后第 7 天达到高峰,并至少维持到 28 天,与此相反,脾脏和血液中 Tregs 比例在整个过程中几乎没有变化。在心肌缺血 / 再灌注损伤、低温损伤后,均观察到类似的 Tregs 积累。这些结果表明 心脏损伤后 Tregs 数量发生了显著变化,提示其可能发挥独特的作用。为鉴定心脏 Tregs 的转录组特征,他们从心肌梗死后 7 天的心脏、脾脏和非引流淋巴结 (NLNS) 中分离 Tregs 进行转录组测序。数据分析结果表明,心脏 Tregs 与脾脏或 NDLN 的 Tregs 均存在较多的差异基因,而脾脏与 NDLN 之间的差异基因却很少。这表明, 心脏 Tregs 转录组明显不同于脾脏或 NDLN,具有独特的特征,而后者则有更多的相似之处。研究人员从已发表数据中获取了皮肤和肌肉的 Tregs 转录组数据,然后将两者与心脏 Tregs 进行综合分析,主成分分析和转录组分析表明,这三种组织在转录组层面上存在显著差异。在心脏 Tregs 中显著上调的差异基因是具有组织特异性的。此外,通过对心脏 Tregs 中上调的基因进行富集分析发现,涉及细胞外结构组织、细胞外基质组织、胶原代谢过程、胶原生物合成过程、创面愈合和平滑肌细胞增殖的调节等与组织修复相关的生物学过程均被富集,这提示这种心脏 Tregs 是一种新的组织 Tregs,可能参与心脏修复过程。研究人员首先探究了外周循环 Tregs 池是否促进了心脏 Tregs 的积累。他们对小鼠进行 FTY720 处理,FTY720 是一种 S1P1 受体激动剂,可保留次级淋巴组织中的淋巴细胞,即减少外周中淋巴细胞的数量。结果发现,在 FTY720 治疗下,心肌梗死后第 3 天和第 7 天,招募到缺血心脏的 Tregs 数量和比例均显著下降,而浸润到梗死心脏的 CD4+T 细胞数量也显著下降。这些结果表明 心肌梗死后心脏 Tregs 的积累可能依赖于循环 Tregs 池。除了循环 Tregs 池的流入,Tregs 本身的增殖也可能使其在肌梗死后快速在心脏积累。为了验证这种可能性,研究人员用 Ki67 对 Tregs 进行染色,结果发现约 75% 的心脏损伤心肌梗死后 7 天 Ki67 阳性,显著高于脾脏和 NDLN Tregs。为了确定心肌梗死后心脏 Tregs 扩增的克隆性,他们对心肌梗死后 7 天的心脏和脾脏的 CD4+ T 细胞进行配对单细胞转录组测序和 TCR 测序。通过对细胞 TCR 的分析,来探讨了心脏 Tregs 细胞的克隆限制性。结果发现,相当一部分心脏 Tregs 细胞存在 TCR 克隆扩增,相比之下,脾脏 Tregs 克隆扩增的频率要低得多;同时,脾脏 Tregs 与心脏 Tregs 只有少数 TCR 序列是共享的。这些结果证明 心肌梗死后心脏 Tregs 的独特 TCR 库及其局部克隆扩增特征。心肌梗死后,心脏 Tregs 增加及积累的内在机制通过转录组分析结果中的差异基因列表,程翔等发现 IL-33 受体 ST2 的编码基因 Il1r1l 在心脏 Tregs 中显著上调。考虑到 IL-33 与实质组织中 Tregs 稳态相关,心脏 Tregs 可能在 IL-33 的作用下积累和扩大。为此,研究人员利用流式细胞术检测心肌梗死后 Tregs 中 ST2 蛋白的动态变化。结果发现,ST2+ 心脏 Tregs 的比例在第 3 天升高,并持续到至少 28 天,并且心脏内 ST2+ Tregs 的百分比远高于脾脏 Tregs,同时,心肌梗死后 Il33 转录和 IL-33 蛋白水平均也呈现升高趋势,并在第 5 天达到峰值。在此基础上,他们进行了一系列敲除和过表达实验,以系统评估 IL-33/ST2 轴在心肌梗死后心脏 Tregs 积累中的作用。与野生型 (WT) 小鼠相比,Il1rl1-/- 小鼠在心肌梗死后 7 天,其心脏 Tregs 数量明显低于野生型组,而脾脏 Tregs 在两组中却无明显变化;使用重组 IL-33 诱导心肌梗死后 7 天,心脏和脾脏 Tregs 的数量和比例均显著增加。 这些结果表明 IL-33/ST2 轴可通过促进 Tregs 增殖诱导心脏 Tregs 的积累。为进一步阐明心肌梗死后心脏 Tregs 促进组织修复的机制,研究人员对心脏 Tregs 的转录组数据进行分析,发现 Sparc 是心脏高表达差异基因中最显著的差异基因之一,实时定量 PCR 结果也证实了心脏 Sparc 的高转录水平。作为一种胶原结合母细胞蛋白,Sparc 在胶原组装成细胞外基质 (ECM) 中起关键作用,已有报道其在心肌梗死后的心室完整性保护中起关键作用。为了从功能上确定 Sparc 是否在心肌梗死后心脏 Tregs 介导的组织修复中发挥作用,他们使用抗 CD25 抗体来消耗 Tregs,并对小鼠进行过表达 Sparc 处理。结果发现, 与对照组相比,Sparc 治疗的 Tregs 消耗小鼠心肌梗死后心脏破裂数量显著减少,其存活率得到显著提高。将心肌成纤维细胞与 Tregs 共培养,发现过表达 Sparc 会使 Tregs 表达的 Col3a1 水平高于其他对照组。这些结果表明,Sparc 在心肌梗死后心脏 Tregs 促进胶原含量的增加层面发挥了至关重要的作用。综上所述,该研究首次鉴定了一个独特的、具有修复功能的心脏 Tregs 群体,该群体主要从外周循环中迁移,同时伴有自身增殖能力的增加。机制层面,这群心脏 Tregs 的积累主要依赖于 IL-33/ST2 轴,另外这些增加的心脏 Tregs 通过高表达 Sparc 来增加胶原的含量和促进梗死瘢痕的成熟,以此发挥对心肌梗死后心肌修复、心脏完整性的保护作用。该研究首次揭示了心脏局部组织特异性 Tregs 的表型和功能特征,为以 Tregs 为基础的心脏免疫治疗提供了新的思路和靶点。华中科技大学同济医学院附属协和医院心血管内科夏霓、卢玉枝及辜慕阳为并列第一作者,程翔为通讯作者。

![]()