曾经帮人度饥荒,如今让你囤脂肪!王立峰等 Cell 报道这个远古 miRNA 为何让人「难瘦」
远古时期,我们的祖先的生活并不像现在这么富足。无法获得稳定食物来源,使得对碳水化合物,脂肪以及盐的渴望被刻进了人类的基因之中。
这些基因也成为了我们解决三高与肥胖问题路上最大的障碍。
图片来源:Cell
2020 年 10 月 14 号,来自麻省总医院的王立峰以及加州大学伯克利分校 Anders M. Näär 团队在顶级期刊 Cell 上刊登了题为 A MicroRNA Linking Human Positive Selection and Metabolic Disorders 的研究 [1],报道一种曾经帮助远古人类熬过饥荒,却危害现代人类健康的 miRNA。
研究内容:
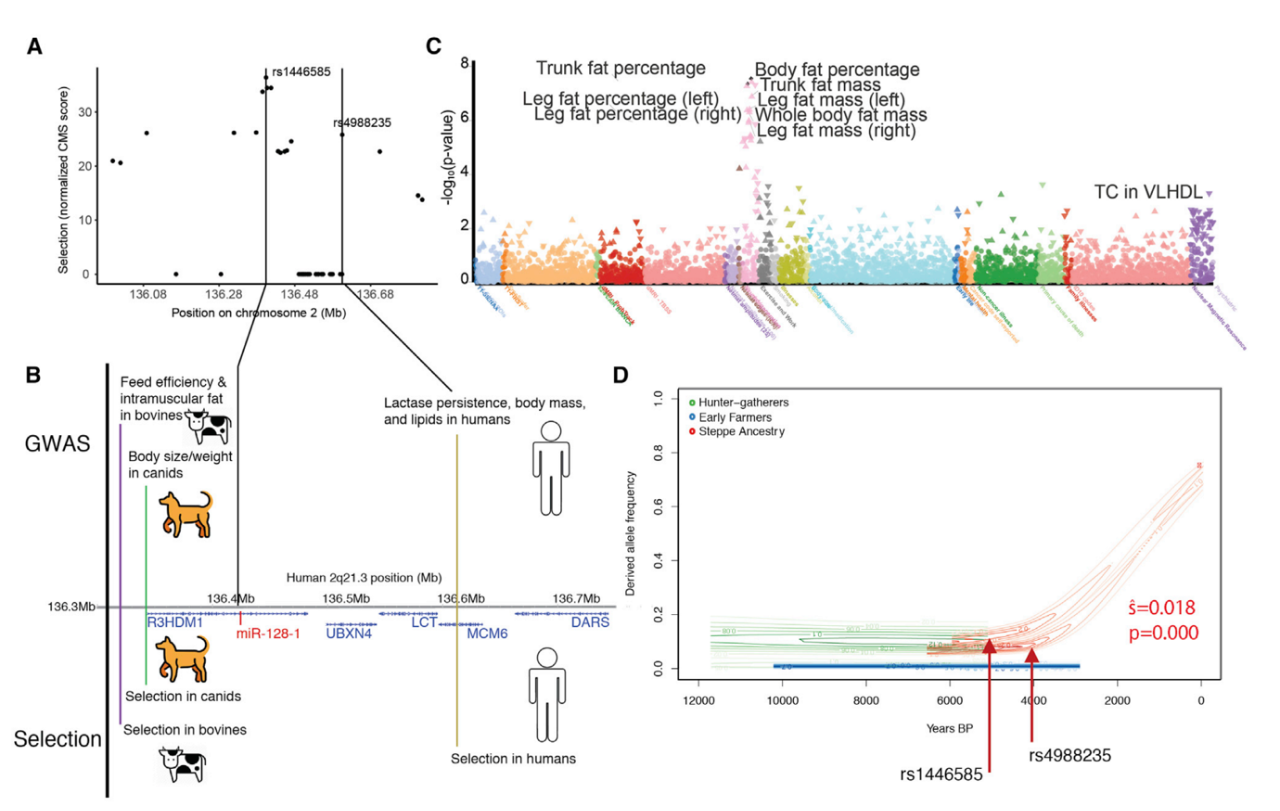
在人类基因组的 2q21.3 区域中,存在着大名鼎鼎的乳糖酶基因。这个曾在远古时期帮助人类消化牛奶中的乳糖,并以此囤积脂肪度过饥荒的基因,却造成了现代社会中肥胖问题。
后续研究也证明,这个长达一百万碱基的区域上不止有乳糖酶基因,在这个区域上的其他基因也与多个物种的代谢息息相关。
图片来源:Cell
因此,作者选择了广泛存在乳糖酶持续(Lactase persistence)现象的欧洲人作为研究对象,并对他们的 2q21.3 单倍型进行了分析。结果显示,这段序列在进化的过程中高度活跃,且和乳糖酶持续现象关系紧密。
在 2q21.3 区域中心的 R3HDM1 基因上,研究团队发现了一些点突变非常靠近他们此前所发现的,与脂质代谢高度关联的 miRNA 序列,miR-128-1。与此同时,在人工选择和自然选择的情况中,牛与犬科等其他物种的 R3HDM1 也显示出与「节俭表型」(thrifty phenotype)的相关性。该区域的等位基因与体重上升出现了显著的相关。种种迹象表明,2q21.3 区域对生物的代谢表型至关重要。
图片来源:Cell
进一步的全表型关联分析 (Phenome wide association study,PheWAS) 结果显示,包括影响乳糖酶持续现象在内的 2q21.3 长单倍型与身体脂肪表型相关性极强,但由于犬科等其他物种中不存在乳糖酶持续现象。因此,作者认为 2q21.3 上除了与乳糖酶持续现象有关的基因,其他部分也参与到了关于代谢的自然选择之中,2q21.3 这段极长的序列是作为一个整体被选择。
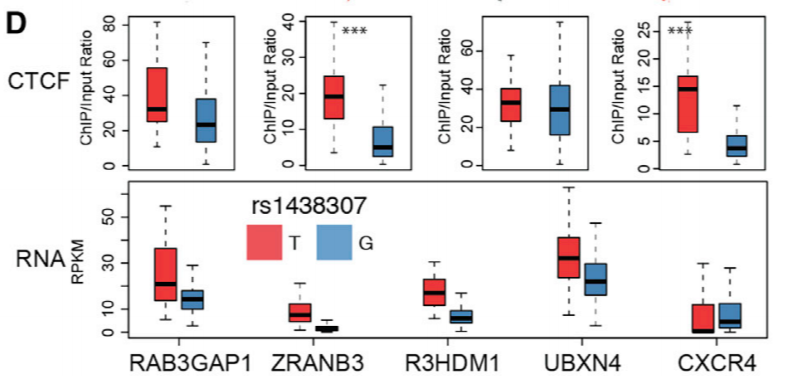
为了找到哪些些细胞类型被 2q21.3 影响。作者对 127 种人类细胞类型的染色质状态图谱进行了分析。结果显示,2q21.3 与血液,婴儿大脑以及包括脂肪细胞在内的间充质细胞有关。在 2q21.3 上一个包含 R3HDM,miR-128-1 与 ZRANB3 的偶联结构域 (Topological Associated Domain, TAD) 边缘,作者发现了一个编号为 rs1438307 的突变,而 rs1438307 为 T 的等位基因出现了更高的染色质开放性。
rs1438307 T 等位基因通过表观遗传学调控了染色质开放性以及整个区域基因表达的变化。后续实验也证明 rs1438307 T 等位基因参与了 miR-128-1 启动子的打开,miR-128-1 在不同 2q21.3 单倍型欧洲人的白色脂肪组织(WAT)中出现了明显的差别。
图片来源:Cell
鉴于 2q21.3 上的正向选择导致了 miR-128-1 的升高,作者认为 miR-128-1 的表达可能在能量消耗与代谢调节中起到了关键作用。
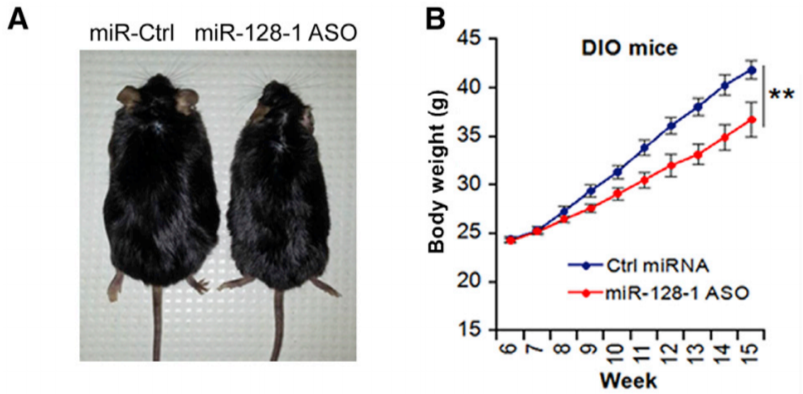
为了验证这个假设,作者使用抗 miR-128-1 寡核苷酸,抑制了高脂饮食 (high fat diet, HFD) 诱导的肥胖小鼠体内的 miR-128-1。结果显示,抑制 miR-128-1 显著降低了小鼠在 HFD 模型中体重的增加,相应的脂肪组织重量也出现了显著的降低。
对这些小鼠的棕色脂肪组织(BAT),WAT 与肝脏等组织进行组学检测的结果显示,注射过抗 miR-128-1 寡核苷酸的小鼠组织中的脂肪堆积与炎症反应显著少于对照组,BAT 标记物却出现了显著的上升。Prdm16, Ppargc1a 与 Ppara 等已知被 miR-128-1 调控的基因也出现了预期之中的变化,而这些基因与脂肪代谢关系非常紧密。其他不同组织中由肥胖导致的基因表达变化,也得到了显著的缓解。
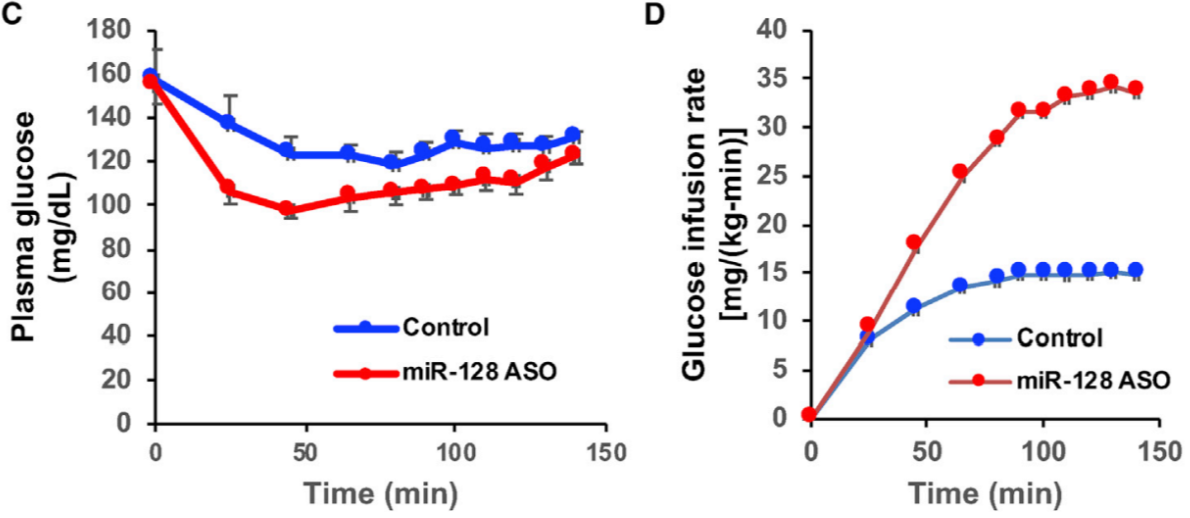
图片来源:Cell
除此之外,作者也检测了这些肥胖小鼠体内的糖代谢功能。糖耐实验结果显示,在注射了抗 miR-128-1 寡核苷酸后,肥胖小鼠体内的糖代谢紊乱得到了极大的改善。在胰岛素的刺激下,实验组小鼠的血糖控制的更加稳定,其骨骼肌与肝脏对胰岛素也更加敏感。这些数据表明 miR-128-1 在糖代谢中也起到关键作用。miR-128-1 在脂质代谢与糖代谢中的作用也在转基因肥胖小鼠中得到了进一步证实。
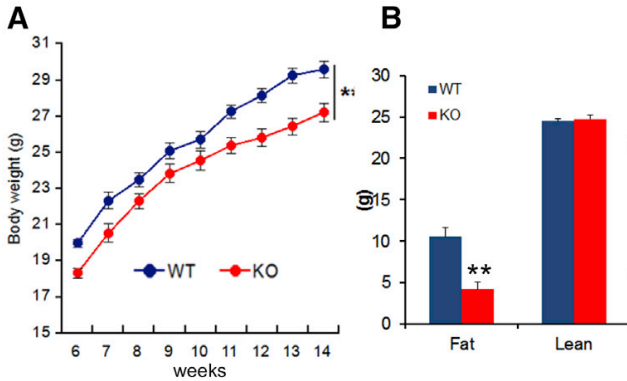
图片来源:Cell
在通过寡核苷酸初步确认了 miR-128-1 的作用后,作者对小鼠进行了全身性 miR-128-1 敲除,并再度用 HFD 诱导肥胖。在接受 HDF 喂养 12 周后,miR-128-1 敲除小鼠的 WAT 重量比野生型低了 60%,其能量消耗也远远高于后者。在 miR-128-1 敲除小鼠的 BAT 线粒体中,作者观测到了氧气消耗的显著升高,证明 miR-128-1 敲除加快了 BAT 中的能量代谢。同抗 miR-128-1 寡核苷酸实验一样,敲除 miR-128-1 也对小鼠的糖代谢功能带来的明显的改善。这些数据再次证明了 miR-128-1 在代谢调节中的关键作用。
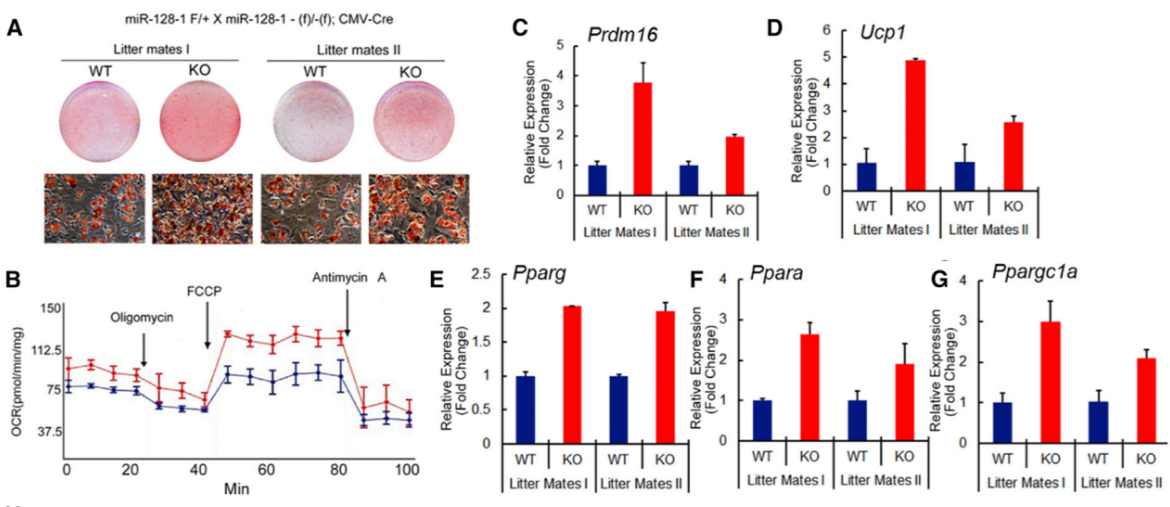
图片来源:Cell
最后,作者在分子层面探究了 miR-128-1 的作用。细胞实验显示,miR-128-1 能够促进 WAT 细胞的分化,并抑制瘦素与脂联素的产生,这一点与体内实验吻合。另一方面,抑制 miR-128-1 似乎导致了 WAT 向 BAT 的转变。
为探究这一问题,作者从野生型和 miR-128-1 敲除小鼠的 BAT 中分离了前脂肪细胞。结果显示,miR-128-1 敲除小鼠的前脂肪细胞分化成 BAT 的能力显著高于野生型小鼠,这也解释了为什么 miR-128-1 敲除小鼠的能量消耗更高。
相应的棕色脂肪细胞标记物在 miR-128-1 敲除后出现的明显的上调。pre-miR-128-1 的加入也能在棕色脂肪细胞中有效的影响其目标基因 Pparg, Ppara 和 Ppargc1a 的表达,而这些基因直接决定能量消耗的多少。与此同时,miR-128-1 可以阻止特定骨骼肌细胞向棕色脂肪细胞的分化。这些数据证明 miR-128-1 在棕色脂肪细胞的细胞命运中扮演着关键的角色。
研究意义:
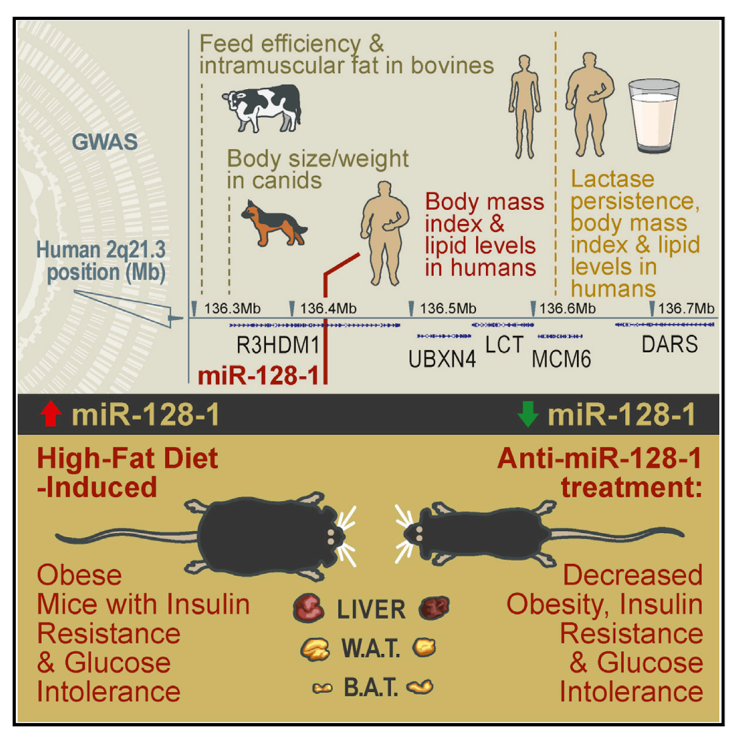
图片来源:Cell
在这项研究中,作者再次确认了 2q21.3 的优势进化在人体代谢功能中的关键作用,并首次将其联系到了 miR-128-1。一系列的细胞与动物实验直接证明了作为 miR-128-1 在能量代谢,脂质代谢以及糖代谢中的关键作用,该研究也在分子层面揭示了 miR-128-1 是如何通过调控 BAT 的细胞命运来改变这些表型。
延伸阅读:
miR-128-1 与代谢之间关系的首次报道可以追溯到 5 年前。

图片来源:Nature Medicine
2015 年,本次新研究的作者王立峰及其导师 Anders M. Näär 在 Nature Medicine 发表了题为 Genome-wide identification of microRNAs regulating cholesterol and triglyceride homeostasis 的论文 [2]。
该研究旨在从基因组层面分析能够调节胆固醇与甘油三酯稳态的 microRNA,也成功找到了数个可以调节胆固醇 - 脂蛋白运输的 miRNA,其中就包括 miR-128-1。
也正是由于 miR-128-1 位于大名鼎鼎的 2q21.3 区域,让研究团队很快建立了两者之间的联系,并更为全面的报道了 miR-128-1 在代谢中的作用。
也许有一天,miR-128-1 抑制剂能够用于代谢紊乱疾病的治疗。









