Nature:换季时瑟瑟发抖?可能是因为这种脂肪细胞太多了!
人类是典型恒温动物,人体的温度基本保持稳定,也有研究表明人类的体温比 200 年前下降了 0.4 摄氏度。脂肪组织产热与皮肤散热在保证体温恒定上起着关键性作用。但是,看似简单的体温维持,还隐藏着更多的奥秘——
人们常常感叹,为什么严寒酷暑我都能抗的住,偏偏换季的几天瑟瑟发抖、常生病呢?体温维持机制在这其中发挥了什么作用呢?
这篇最新 Nature 文章或许能给出一定提示。

2020 年 10 月 28 日,来自苏黎世联邦理工学院 Wenfei Sun 博士与其导师 Christian Wolfrum 教授联手在最新一期的 Nature 上发表了题为 snRNA-seq reveals a subpopulation of adipocytes that regulates thermogenesis 的论文 [1],新发现了一种特殊的脂肪细胞对产热的负向调节作用。
研究内容:
我们体内的脂肪细胞主要由三类组成:负责储藏能量的白色脂肪细胞,负责产热的棕色脂肪细胞,以及介于两者之间的米色脂肪细胞。这些细胞在人体代谢中都扮演着极其重要的角色。尽管此前已经有研究对这些细胞进行了进一步细分,但依旧不足以告诉我们,脂肪是如何调节人体能量稳态的。

因此,来自苏黎世理工的研究团队对不同温度环境中小鼠棕色脂肪组织进行了单细胞核 RNA 测序(single-nucleus RNA sequencing, snRNA-seq),并在 8°C、室温以及 30°C 三种温度环境内的小鼠 BAT 中找到 10 个棕色脂肪细胞亚群。有趣的是,这些细胞亚群与小鼠所处的环境出现了明显的相关性。比如 P1 与 P2 主要存在室温与低温环境的小鼠中,P3 存在于高温组中,P6-10 主要存在于低温组中。而三种条件下都检测出来带有相似细胞核的 P4。
随后,作者使用人体 BAT 进行了相同的试验。从 16 个人的数据中,研究团队分出了 8 个细胞亚群,并发现多个人体棕色脂肪细胞亚群也表达 P4 标记物。进一步分析证明,人体 BAT 的 P4 细胞亚群占比远高于 P4 在 WAT 中的占比。这些数据初步表明 P4 细胞亚群在 BAT 中可能起到了重要的作用。
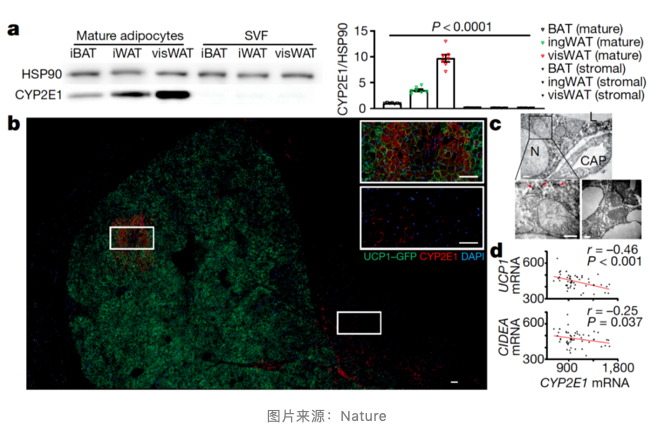
为了进一步剖析 P4 细胞亚群,作者对 P4 最显著的标记物 Cyp2e1 进行了体内检测。免疫染色结果显示,Cyp2e1 阳性脂肪细胞在小鼠肩胛骨间棕色脂肪组织(iBAT)与毗邻的肩胛下白色脂肪组织(subscWAT)中广泛存在,占总脂肪细胞的比例分别高达 10% 与 20%。通过对 P4 标记物与 BAT 和 WAT 中其他脂肪细胞的标记物库进行对比,作者确认了 P4 不属于任何一种现存分类,这是一种全新的脂肪细胞亚群。
更值得注意的是,P4 细胞在低温组的 BAT 中出现了明显的下降,而在高温组中出现了上升,证明 P4 可能是随着温度升高而新形成的脂肪细胞。同时,在人类深颈 BAT 中,作者发现了比例更高的 P4 细胞亚群,这或许是因为人类处在热平衡的环境(类似于小鼠的高温组)的时间远超小鼠。
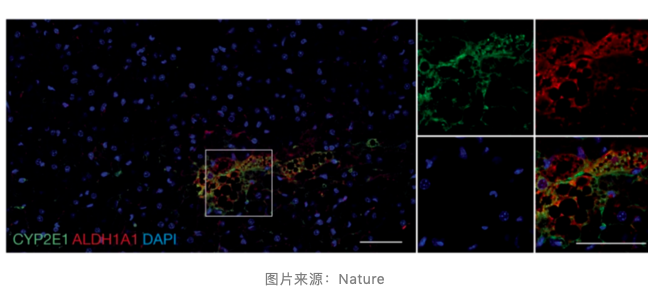
通过电子显微镜的观测,研究团队发现 P4 细胞的线粒体比其他脂肪细胞更小,这证明这些细胞的功能可能受损。因此,他们对 P4 细胞中于 Cyp2e1 共同表达的基因进行了筛选,并发现一个于产热有关的基因 Aldh1a1,该基因与 Cyp2e1 关系紧密。Aldh1a1 与 Cyp2e1 染色结果在各种脂肪组织中呈现出完美的重合,进一步印证了它们的关系并不一般。
为了验证 Aldh1a1 的作用,研究团队使用 shRNA 对 Aldh1a1 进行了敲低。在低温环境中,Aldh1a1 敲低的小鼠呈现出了更高的颈部表面温度以及负责非颤抖性产热的 UCP1 表达。同时,这些小鼠的 iBAT 也消耗了更多的葡萄糖与氧气。敲入 Aldh1a1 则得到了相反的结果。这些数据证明,Aldh1a1 的表达水平与 iBAT 的产热能力息息相关。
值得注意的是,P4 细胞在整个 iBAT(包括非脂肪细胞) 的占比仅为 2.9%。如此低的百分比却能对整个组织的产热能力造成如此大的影响,说明比起仅仅改变自身的产热,P4 细胞很有可能能够控制其他细胞的产热。
为了验证这个假设,作者分离出了 iBAT 中的脂肪细胞进行了体外试验。在通过 siRNA 敲低 Aldh1a1 后,这些细胞的 UCP1 表达出现了巨大的变化。考虑到 P4 细胞仅占 iBAT 脂肪细胞的 17%,研究团队认为这很有可能是由 P4 细胞的旁分泌调节实现的。
进一步分析 siRNA 敲低试验的结果后,作者发现 Aldh1a1 敲低的程度与脂肪细胞耗氧量的增加并未呈现线性关系,这证明 P4 细胞不是造成耗氧量增加的全部原因。通过 P4 细胞和非 P4 细胞的共同培养,作者证实了 P4 细胞能够通过旁分泌影响其他脂肪细胞的产热。
随后,作者探究了 P4 细胞是通过什么机制进行这种旁分泌调节。在排除了此前被报道能够影响 BAT 功能,且受 Aldh1a1 调节的视黄醛后,作者将目标锁定在了乙酸盐上。
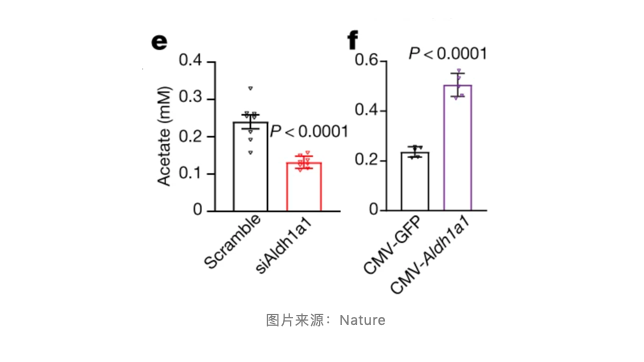
此前有研究报道 Aldh1a1 能够将乙醛转化为乙酸盐,所以作者在敲低 Aldh1a1 后,检测了脂肪细胞培养液中乙酸盐的含量。不出所料,在敲低 Aldh1a1 后,脂肪细胞乙酸盐的水平降低了 2 倍。而乙酸盐的水平与 UCP1 的表达呈现出明显的剂量效应,并顺藤摸瓜找到了脂肪细胞表面的乙酸盐感受器 G 蛋白偶联受体 43(GPR43),GPR43 激动剂能够有效的抑制脂肪细胞的氧气消耗,这与乙酸盐的作用一样。这一系列试验揭示了 P4 细胞通过影响乙酸盐水平来调节脂肪产热的具体机制。
研究意义:
该研究通过高通量 snRNA-seq 技术,不仅找到了一种全新的脂肪细胞亚型,更证明了这种细胞亚型对脂肪产热具有重要的调节作用。尽管 P4 细胞所占脂肪细胞比例不过 20%,所占脂肪组织内细胞比例也仅为个位数百分比,其对整个脂肪组织产热系统带来的影响是巨大的。
另一方面,除了本文关注的 Aldh1a1,作者还在 P4 细胞中确定了多个标记物。这些蛋白是否在 P4 细胞的功能中扮演着重要的角色?还需要更多的研究来探究。
换季时感觉更冷,是否因为这类脂肪细胞比例一时无法适应环境呢?期待更多的研究!