同天两篇 Science,揭晓 miRNA 靶向降解机制,解了悬而未决近 30 年的谜题
背景介绍:
MicroRNAs (miRNAs) 是一类由内源基因编码的长度约为 22 个核苷酸的非编码单链 RNA 分子,参与转录后基因表达调控,抑制信使 RNA (mRNAs)。
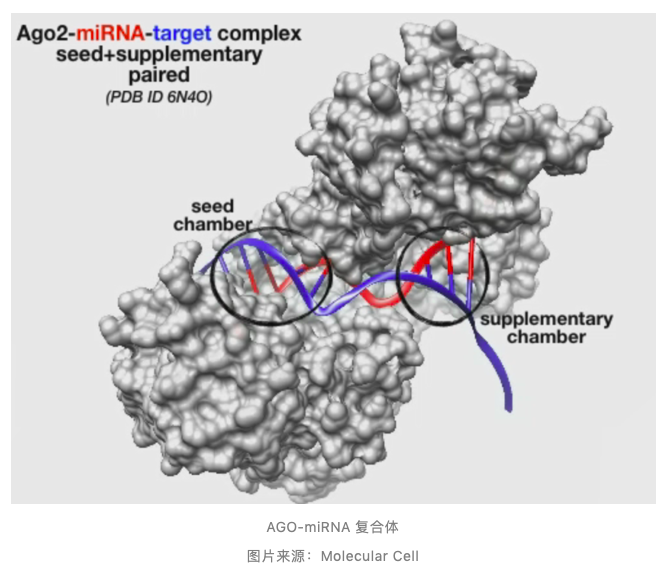
Argonaute (AGO) 蛋白是 RNA 介导的转录后基因调控的关键蛋白,为 miRNA 提供锚位点,形成 RNA 诱导沉默复合体 RISC 达到降解靶基因或者抑制翻译的目的。 自 1993 年 miRNAs 被发现以来,研究人员已经积累了数百种不同 miRNA 分子及其生成、成熟在发育、生理和疾病中的作用机制。尽管人类早已明确 miRNA 半衰期非常短,细胞在使用完毕后如何处理(降解)miRNA,精确调控 miRNA 周转机制的蛋白和执行策略知之甚少。 近三十多年来,研究人员一直在寻找细胞降解 miRNAs 的机制。近日,Science 杂志同期发表了两篇关于细胞降解 miRNAs 新机制的重磅研究成果。 德克萨斯大学西南医学中心分子生物学系 Joshua T. Mendell 教授研究团队发现了一种细胞降解 miRNAs 的新机制。该成果以 A ubiquitin ligase mediates target-directed microRNA decay independently of tailing and trimming 为题于 2020 年 11 月 12 日在 Science 杂志在线发表。

AGO 蛋白在 miRNA 通路中发挥多种功能,通过产生 pre-miRNA 参与 miRNA 装配;同时 AGO 蛋白是 RISC 效应器蛋白,介导 mRNA 降解、去稳定作用或者转录抑制。 如前所述,装载至 AGO 蛋白中的 miRNAs 具有其周转 (turnover) 动力学。通过靶向 miRNA 的降解 (target-directed miRNA degradation, TDMD) 效应,诱导 miRNA 快速降解。目前,认为 TDMD 效应与加尾 (tailing, 加上 U 或 A) 和修剪 (trimming, 截短) 有关,但 TDMD 介导 miRNA 降解机制尚未阐明。
Joshua T. Mendell 教授研究团队通过 3' UTR 的 8 个与 miR-7 结合位点完全互补的增强型绿色荧光蛋白 (EGFP) 转录本 EGFPmiR-7,成功构建了可监测 miR-7 活性的荧光报告 K562 细胞株。 采用全基因组 CRISPR 筛选策略,Joshua T. Mendell 教授研究团队希望通过对已知 CYRANO-miR-7 中 TDMD 效应的鉴定,初步筛选执行 TDMD 的调控因子。 此外,为判断 TDMD 依赖性调控 miR-7,研究人员在 CYRANO-/- EGFPmiR-7 报告细胞中进行了平行全基因组 CRISPR 筛选。
全基因组 CRISPR-Cas9 筛选锁定 ——ZSWIM8 泛素连接酶
全基因组 CRISPR 筛选鉴定后发现在 CYRANO 依赖的结合位点中,cullin-RING 泛素连接酶 (CRL) 的组件得分最高 (ZSWIM8、ELOB、ELOC、CUL3、RBX1 和 ARIH1),而 CRLs 是 E3 泛素连接酶的最大超家族。
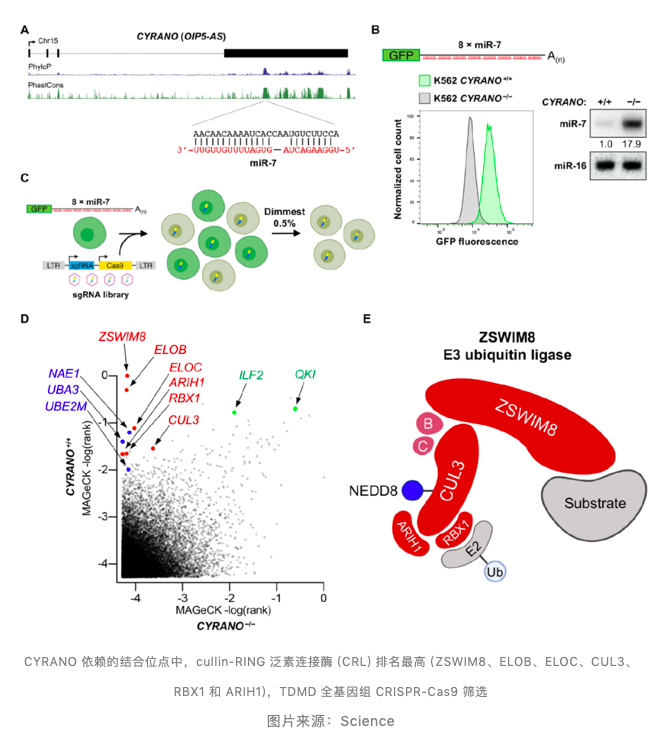
ZSWIM8 E3 泛素连接酶及其组件是 TDMD 必要条件
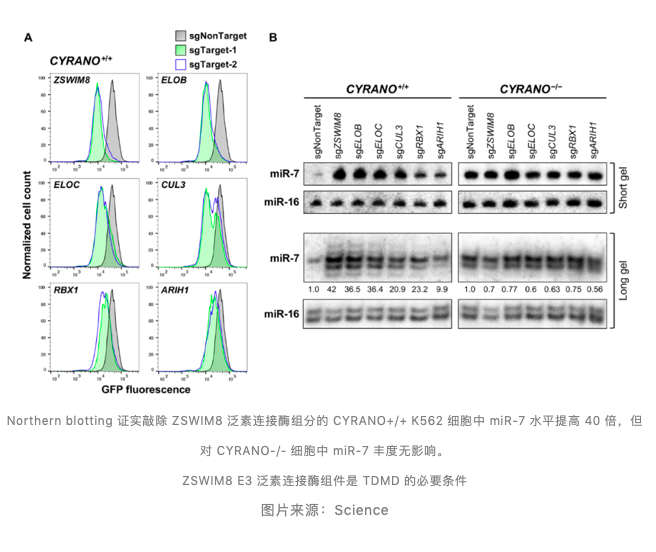
与全基因组 CRISPR-Cas9 筛选结果一致,敲除 ZSWIM8 泛素连接酶的每个单独组件成分均可导致 EGFPmiR-7 报告基因在 CYRANO+/+ 细胞中被抑制,证实 ZSWIM8 E3 泛素连接酶及其组件是 TDMD 的必要条件。
一专多能 ——ZSWIM8 泛素连接酶功能的普适性
接下来,Joshua T. Mendell 教授研究团队测试了 ZSWIM8 泛素连接酶功能的普适性 —— 即 ZSWIM8 泛素连接酶是否仅可在 CYRANO 诱导的 TDMD 中特异性发挥功能,还是在其他 TDMD 中同样存在。
NREP 是一种蛋白质编码基因,在其 3 ' UTR 中包含 miR-29b 结合位点,可触发这种 miRNA 降解。Joshua T. Mendell 教授研究团队分别克隆了人 NREP 下游 3 ' UTR 基因(包含 miR-29b 结合位点)和突变 miR-29 结合位点(NREP_29a/b)。
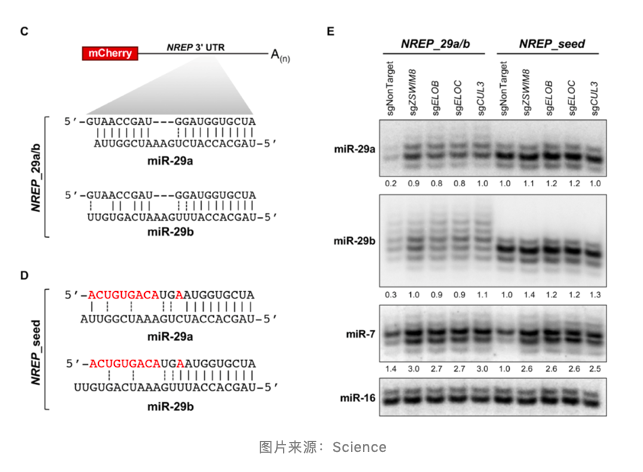
敲除 ZSWIM8 CRL 组件可稳定 NREP_29a/b 表达细胞中的 miR-29a 和 miR-29b。同表达与 miRNA - 互补的突变 NREP 转录本细胞相比,该转录本的表达导致 miR-29a 和 miR-29b 的下调。NREP_29a/b 促进了 miR-29a 和 miR-29b 的加尾化,敲除 ZSWIM8 复合物组件成分使上述修饰进一步在细胞中积累。
在不同细胞系中,ZSWIM8 泛素连接酶在两种诱导 TDMD 途径中均可发挥作用。此外,上述结果还证实 3' miRNA 修饰不足以触发 miRNA 降解。 ZSWIM8 CRL 与 AGO2 相互作用TDMD 蛋白酶体活性是关键
通过免疫共沉淀等实验,证实 ZSWIM8 复合体与 AGO2 存在相互作用。ZSWIM8 泛素连接酶促进参与 TDMD 相互作用的 AGO 蛋白降解,导致靶向 miRNA 释放并最终降解。
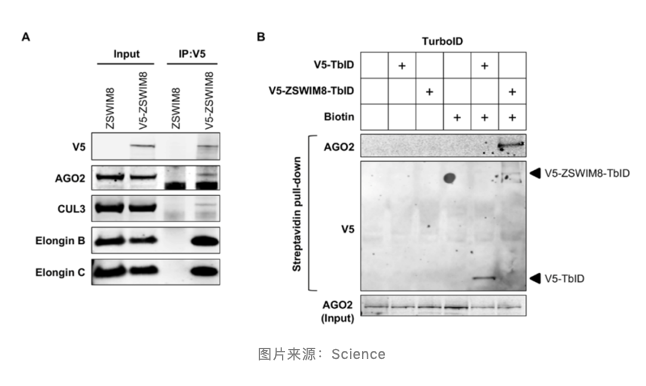
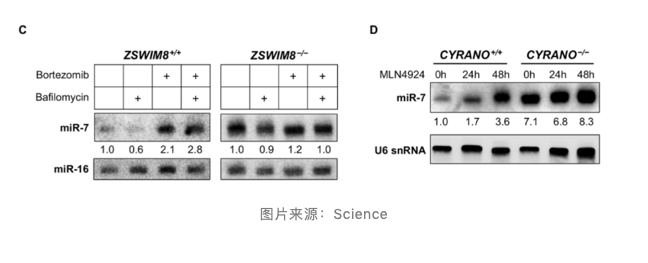
此外,抑制蛋白酶体活性保留溶酶体活性,可部分抑制以 ZSWIM8 依赖方式进行的 TDMD miRNAs 降解效应。
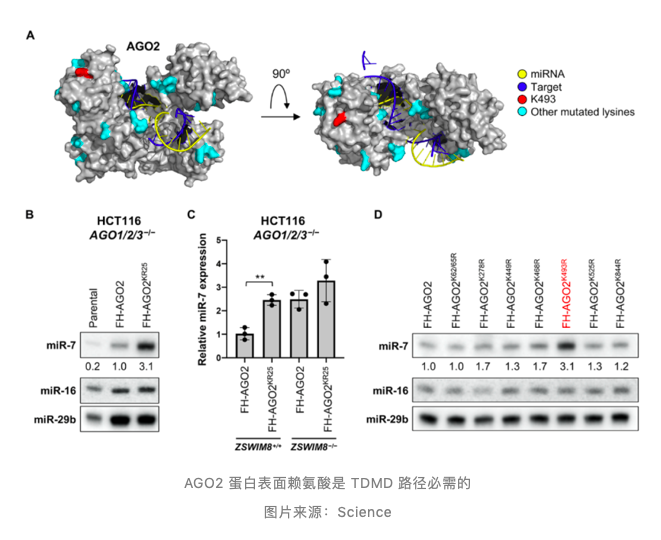
AGO2 表面赖氨酸是 TDMD 关键位点
在 ZSWIM8 泛素连接酶促进 TDMD 途径诱导靶点 AGO 蛋白降解的预测模型中,特异的赖氨酸残基作为泛素修饰的受体,对 AGO 蛋白降解过程至关重要。通过将 25 个赖氨酸分别单独或成对突变为精氨酸,并检测突变后的 AGO1/2/3 三敲细胞中 miR-7 水平变化,证实 AGO2 蛋白表面赖氨酸是 TDMD 路径必需的。
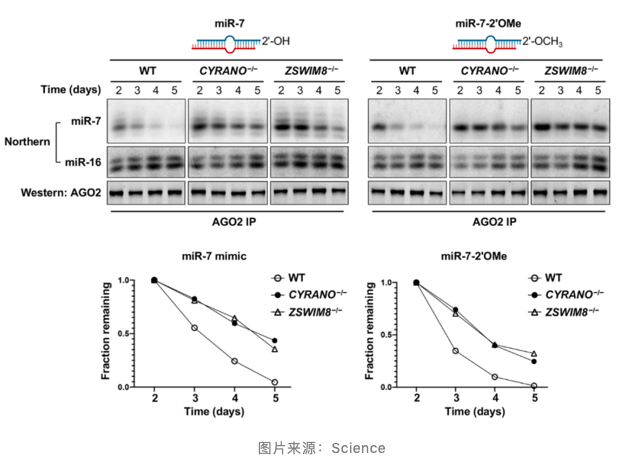
ZSWIM8 泛素连接酶介导的 TDMD 不需加尾和剪切
在 ZSWIM8 敲除细胞中与 TDMD 底物结合的 miRNA 加尾和剪切中间产物积累,提示 3'miRNA 修饰不足以触发 miRNA 降解。作者含有或不包含 3'- 末端 2'- 甲基(3'miRNA 修饰)miR-7 双体证实了 3' 修饰 miRNAs 可能是 TDMD 途径的必要中间体,其可能作为 ZSWIM8 复合物招募的信号。
ZSWIM8 复合体在多种细胞中均可调节 miRNA 降解
最后,Joshua T. Mendell 教授研究团队通过 RNA 测序证实除了 K562 细胞外,ZSWIM8 复合体在 HEK293T 细胞等多种细胞中均可调节 miRNA 的表达。
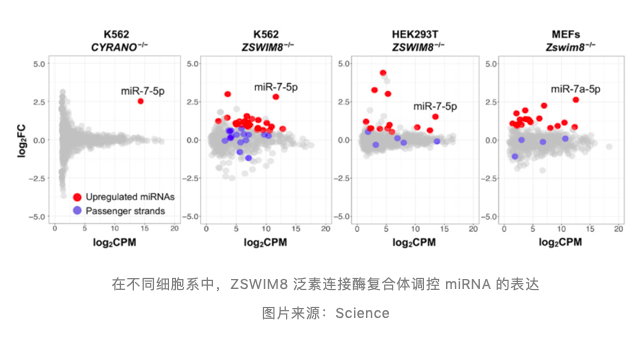
研究总结
TDMD 早在十多年前就被发现,但通过这一途径介导 miRNA 降解的分子机制一直是一团迷雾。
Joshua T. Mendell 教授研究团队报道的 ZSWIM8 cullin-RING 泛素连接酶是 TDMD 介导 miRNA 降解的关键机制。ZSWIM8 cullin-RING 泛素连接酶在 TDMD 塑造不同细胞 miRNA 稳定性和多样性方面发挥了重要作用。
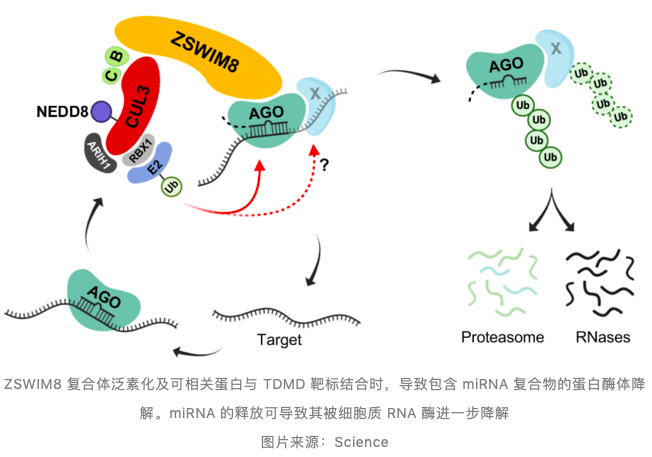
miRNA 降解机制在动物发育期间和跨组织中广泛地控制 miRNA 的水平。考虑到大量研究证实 miRNA 的异常水平与各种疾病有关,寻找控制 miRNA 降解的方法 —— 无论是根除细胞中有问题的 miRNA 还是保留有益的 miRNA—— 可能代表一种基于基因调控的新的疾病解决方案。










