基因编辑已获奖,快看看什么方向适合你

基因编辑技术是一种通过使用靶序列特异性工程核酸酶来操纵真核基因组的新兴治疗手段,包括模型细胞系的开发、疾病机理的发现、疾病靶标的确定、转基因动植物的开发和转录调节。
由于基因编辑技术在促进基因组中序列的正确校正方面所具有的特殊优势,基于基因编辑的疗法正被积极地开发为治疗多种疾病的下一代治疗方法。到目前为止基因编辑系统历经 3 代,包括锌指核酸酶(ZFN)、转录激活因子样效应子核酸酶(TALEN)和 CRISPR/Cas9。
1. 锌指核酸酶(zinc-finger nuclease,ZFN)
通常基因插入/删除步骤包括:(1)基因组的某确定区域双链断裂(DSB),(2)修正缺陷内源基因或引入外源基因,(3)DSB 修复。
真核生物中的 DSB 修复有两种内源性修复机制:非同源末端连接(NHEJ)或同源直接修复(HDR)。NHEJ 在生物体内发生频率高,但准确性低。为了降低非特异性突变,提高基因编辑保真度,研发人员开发了一种工程核酸酶——锌指核酸酶(ZFN)。
ZFN 技术诞生于 1996 年,直到 2002 年,Bibikova 等第一次用 ZFN 的方法通过在果蝇中成功突变了 yellow 基因。ZFN 是 Cys2-His2 锌指蛋白(ZFP)和衍生自 FokI 核酸内切酶的非特异性 DNA 限制酶的融合蛋白,可靶向的 DNA 裂解试剂,已被用作基因靶向工具,ZFPs 在真核细胞中很常见,并与转录调控和蛋白质-蛋白质相互作用相关。
ZFN 的 DNA 结合域通常含有 3 个独立的 ZF 重复结构,每个 ZF 结构能够识别 3 个碱基,因而一个锌指 DNA 结合域可以识别 9 bp 特异性序列,ZFN 二聚体(含 6 个锌指)可以识别 18 bp 长度的特异性序列。ZFN 诱导的双链断裂易受细胞 DNA 修复过程的影响,从而导致靶向诱变和靶向基因的替换均以非常高的频率进行。目前最常用的 ZF 结构为 Cys2 His2 锌指。
ZFN 技术虽然实用,但易产生脱靶现象,因为 ZFN 作用需要两个 FokI 切割区域的二聚化,且至少需要一个识别单元结合 DNA,一旦形成异源二聚体,就很可能造成脱靶效应,并最终导致 DNA 错配和序列改变,当断裂的数目超过了 DNA 的修复能力会产生较强的细胞毒性。
ZFN 另外一个缺点是亲和力不高,虽然经过优化设计后,用较短接头连接 ZF 模块可以提高其特异性,但利用此技术来获得高质量基因编辑产品还有较长路要走。

2. 转录激活子样效应子核酸酶(transcription activator-like effector nuclease, TALEN)
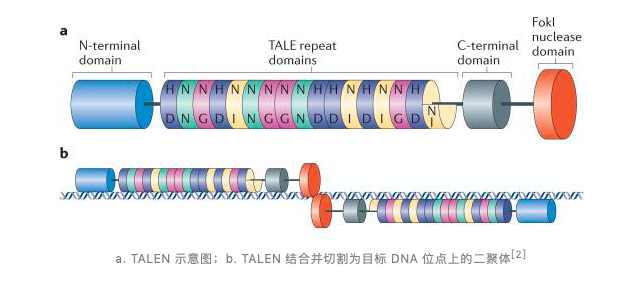
继 ZFN 后,第二代人工核酸酶技术——转录激活子样效应子核酸酶(TALEN)于 2009 年诞生。TALEN 作为 ZFN 的替代品与 ZFN 类似,包含与目的 DNA 结合域融合的非特异性 FokI 核酸酶域,该 DNA 结合结构域由高度保守的氨基酸重复序列组成,这些重复序列来自由黄单胞菌细菌分泌的蛋白——转录激活子样效应物(TALE),包含 33~35 个氨基酸。
该技术利用 TALE 重复结构域中氨基酸序列与其靶位点核酸序列之间有着对应的「氨基酸—DNA」关系,从而能快速设计出特异性结合目的 DNA 的蛋白模块。目前,几乎所有工程 TALE 重复序列都使用四个具有高变残基 NN、NI、HD、NG 的域,分别识别 G、A、C、T。
与 ZFN 相比,两者的成本都较高,TALEN 的设计和使用相对简单,用时更短,虽然也存在脱靶效应,但 TALENs 比 ZFNs 特异性更高且细胞毒性更小。但值得一提的是,TALEN 比 ZFN 大,大概 3 kb 的 cDNA 编码一个 TALEN,而编码单个 ZFN 仅需 1 kb,这使得 TALEN 的递送更具挑战性。
3. 规律间隔成簇短回文重复序列(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR)
CRISPR/Cas 系统是第三代基因编辑工具,是一种原核生物的适应性免疫系统,是细菌和病毒进行斗争产生的免疫武器,用来抵抗外源遗传物质的入侵,如噬菌体病毒和外源质粒等。
简单来说,病毒感染细菌后将自己的基因整合到细菌基因组内用以繁殖,并通常在复制完成后杀死宿主细胞,为了回避这个致命的威胁,细菌进化出了强大的适应性免疫系统—CRISPR/Cas,它由一系列高度保守的短 DNA 重复序列组成,通常为 21~48 bp 的回文序列或短的反向重复序列,这些序列之间被称为间隔子的可变序列片段间隔开,通常介于 26~72 bp 之间,CRISPR 阵列的第三部分是前导序列,其位于第一个重复序列上游,富含 AT,约为 200~500 bp,包括必需的启动子序列。
Cas 的全称是 CRISPR associated,是 CRISPR 基因座相邻基因,编码 Cas 蛋白,Cas 蛋白提供了从入侵元件中获取新间隔子并靶向入侵元件所需的酶促机制。
基于系统发生机制和特定 Cas 蛋白,CRISPR / Cas 系统目前分为六种类型,I~III 型是研究最多的。每种类型可进一步细分为不同子类型,如类型 I 由 IA 到 IF 类型组成。每种类型都由所谓的特征蛋白指定,该蛋白以特定类型保守,但 Cas1 和 Cas2 基因似乎是通用的,被发现存在于大多数 CRISPR/Cas 系统中。Cas3、Cas9 和 Cas10 分别充当 I,II 和 III 型的标志蛋白。
CRISPR/Cas9 是目前研究得最多也是应用最成熟的基因编辑工具。下面小编以 CRISPR/Cas9 为例,介绍一下 CRISPR/Cas 系统的防御机制。
4. CRISPR/Cas 系统防御机制
4.1 外源 DNA 捕获
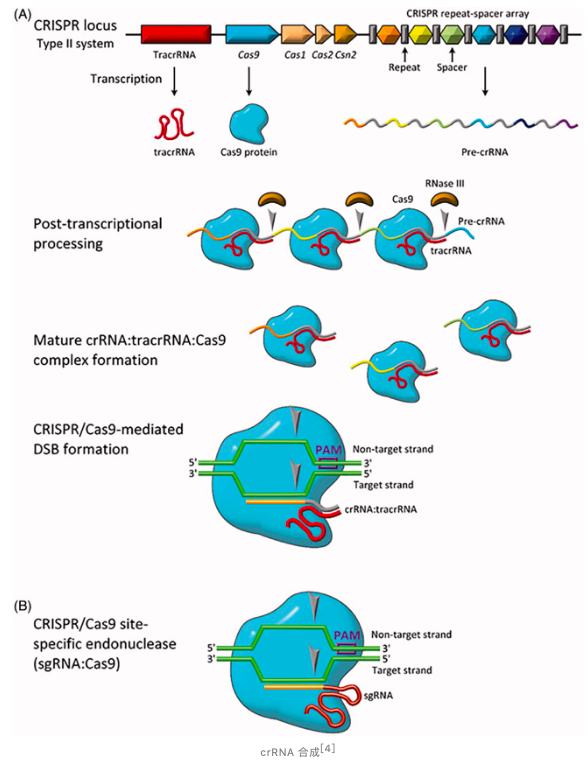
当病毒首次入侵宿主细菌并将 DNA 组注入细胞内部后,Cas1 和 Cas2 蛋白将扫描这段外源 DNA,识别 DNA 中的原间隔序列临近基序(protospacer adjacent motif,PAM),并截取原间隔序列(protospacer)整合到 CRISPR 序列前导区的 下游,随后 DNA 进行修复。

4.2 crRNA 合成
CRISPR 基因组由三个部分组成:tracrRNA 基因、Cas 基因、CRISPR 重复序列和间隔区序列。当病毒再次入侵时,这些三部分被转录为 tracrRNA,Cas 蛋白和 pre-crRNA。
tracrRNA 具有发卡结构,pre-crRNA 是由整个 CRISPR 序列转录而成的大型 RNA 分子。随后,tracrRNA、pre-crRNA 和 Cas9 形成复合物,并且由 RNase III 在重复序列处切割将 pre-crRNA 加工成 crRNA,从而形成由 crRNA 引导的 crRNA:tracrRNA:Cas9 核酸内切酶复合物。
4.3 靶向干扰
随后,Cas9/RNA 复合物随机扫描细胞中的 DNA,首先寻找合适的 PAM,识别出 PAM 序列后,如果被扫描的 DNA 序列与 crRNA 靶序列匹配,则 Cas9/RNA 复合体将从 PAM 序列后的前 10~12 个核苷酸解开 DNA 形成 R-Loop。随后,Cas9 的 HNH 核酸酶活性将切割 crRNA 互补的 DNA 链,而 RuvC 活性将切割非靶链,从而沉默外源 DNA。
5. CRISPR/Cas9 系统的应用
第三代基因编辑技术 CRISPR/Cas 的出现为人类基因编辑提供了新的可能性,随着近年来分子生物学的快速发展,它已广泛应用于许多领域,特别是在遗传疾病治疗、疾病相关基因的筛选和检测、肿瘤治疗、动植物转化以及病原微生物的预防等领域具有巨大的潜力,可以有效改善人类的生活质量。
5.1 遗传疾病的矫正
CRISPR/Cas9 最受关注的应用之一是其在治疗由单基因突变引起的遗传性疾病中有巨大潜力。如囊性纤维化(CF)、杜兴氏肌营养不良症(DMD)和血红蛋白病等。
Tabebordbar 等人使用腺相关病毒(AAV)递送 CRISPR/Cas9 系统,通过删除含有原始突变的外显子来恢复 DMD 小鼠模型中的肌营养不良蛋白表达,显示治疗的小鼠可部分恢复肌肉功能缺陷。
Canver 及其同事的研究表明 CRISPR/Cas9 破坏 BCL11A 增强子可在小鼠和原代人成红细胞中诱导胎儿血红蛋白,这种方法可使胎儿血红蛋白在血红蛋白异常的成人患者中表达,为镰状细胞病或地中海贫血等疾病的提供了新的治疗策略。
5.2 艾滋病毒的治疗
CRISPR/Cas9 的另一个潜在临床应用是治疗感染性疾病,如 HIV。尽管抗逆转录病毒疗法为 HIV 提供了有效的治疗方法,但由于病毒永久整合到宿主基因组中,目前尚无治愈方法。研究表明 CRISPR/Cas9 系统可靶向 HIV-1 基因组活性,使 HIV 基因的表达和复制失活,从而使其可以在多种细胞中潜伏感染,而没有任何毒性作用。
5.3 癌症治疗
CRISPR 系统可结合 CAR-T 进行癌症治疗。CAR-T 细胞疗法是一种利用 CRISPR/Cas9 技术将 CAR 基因递送至 T 细胞基因组特定部位的疗法。研究人员使用 CRISPR 敲除参与免疫排斥的两个基因:T 细胞受体和 Beta-2-微球蛋白可降低同种异体反应性,并降低 CAR-T 的抗原性,获得通用 T 细胞。
5.4 RNA 编辑
张峰等人发现了两种靶向 RNA 的新型 CRISPR 系统。这些新系统利用具有类似特性的 Cas 酶,如 Cas13a 和 Cas13b。Cas13a,以前称为 C2c2,是一种 RNA 靶向酶。Cas13b 具有靶向和编辑 RNA 的能力,仅需一个指导 RNA 即可找到靶标,并可靶向多个 RNA 转录本。该系统将使研究人员可以特异性地操纵 RNA,并以高通量的方式使用 CRISPR 研究广泛的生物学过程。
目前,已发现于 2018 年发现的Cas13d 家族可干扰哺乳动物细胞系中的 RNA 以实现基因沉默。与 RNA 干扰技术相比,Cas13d 介导的基因沉默具有更高的特异性和敲除效率。与 Cas9 介导的基因敲除技术相比,Cas13d 介导的基因沉默不会改变基因组 DNA,因此这种基因沉默具有可逆性,在治疗某些后天代谢疾病方面具有显着优势。与其他 Cas13 家族蛋白相比,CasRx 具有最高的 RNA 切割活性和最小的体积,使其更易于包装到 AAV 中以进行体内递送。
5.5 分子诊断
CRISPR 系统还可用于分子诊断领域,通常使用四种 Cas 系统:Cas9,Cas12,Cas13 和 Cas14。张峰等人在 Cas13a 系统中引入了常温扩增 DNA 的 RPA 技术,并创建了一个新的技术平台——SHERLOCK,其技术的核心原理包括位点特异性扩增:若检测到 DNA,则通过 RPA 扩增;若检测到 RNA,则通过 RT-RPA 扩增。然后将扩增的 DNA 产物转录成 RNA 分子。靶 RNA 通过 Cas13a-crRNA 和报告 RNA 检测。由于其高灵敏度和特异性,这种 CRISPR 诊断技术具有巨大应用前景。
另外,有研究人员将 CRISPR 和石墨烯膜场效应晶体管技术相结合,创建了 CRISPR-Chip 技术。基于石墨烯的晶体管包含 dCas9(仅可识别,无剪切)和 sgRNA 的复合物。将样品运到石墨烯膜上时,dCas9-sgRNA 识别并结合到相应的靶 DNA 分子,晶体管发出电信号。在 SHERLOCK 和 DETECTR 中,「剪切」生成信号;在 CRISPR-Chip 中,结合会产生信号。

6. CRISPR/Cas 系统的递送方法
迄今为止,已有 3,000 多个基因与致病突变相关,基因疗法治疗因基因突变导致的基本虽然普遍成功,但也受到了几次悲剧。
在利用 CRISPR/Cas 治疗患有 X 连锁免疫缺陷症(SCID X-1)的儿童时,校正基因构建体被非特异性地插入部分患者的基因组中,导致 5 名儿童发展为 T 细胞白血病,其中 1 名儿童死于化疗难治性白血病。
在另一场悲剧中,一名患有鸟氨酸转氨甲酰酶(OTC)部分缺乏症的 18 岁男性在接受治疗四小时后,对腺病毒载体产生了大规模的炎症反应而死亡,这两个悲剧都源于治疗性递送方法。所以,CRISPR/Cas 系统的递送方法的选择对于基因治疗十分重要。
CRISPR / Cas9 系统包装通常采用三种方法:(1)同时编码 Cas9 蛋白和 sgRNA 的 DNA 质粒,(2)用于 Cas9 翻译的 mRNA 和单独的 sg RNA,(3)Cas9 蛋白和 sgRNA(核糖核蛋白复合体)。
所使用的运送工具通常将决定采用哪种包装方式,以及该系统在体外和体内是否可用。例如,Cas9 蛋白带正电,而寡核苷酸和 Cas9:sgRNA 带负电。另外,还须考虑如何严格控制 Cas9 的总体浓度。
目前递送方式可分为三类:物理方法、病毒载体和非病毒载体。
6.1 物理方式
显微注射通常被认为是 CRISPR 系统递送的「金标准」,效率接近 100%。此方法可将上述三种包装方式直接注射到单个细胞中,该过程绕过了与通过细胞外基质、细胞膜和细胞质成分递送相关的障碍。此外,显微注射不像病毒载体递送系统受载量限制。但此方法无法用于体内环境,而且显微注射在技术上是一项艰巨而费力的过程。
电穿孔技术利用脉冲高压电流瞬时打开悬浮在缓冲液中细胞的细胞膜,形成纳米级孔,从而使流体动力学直径为数十纳米的成分流入细胞。与其他递送技术相比,电穿孔对细胞类型的依赖性较小,并且可以有效地将组件转移到细胞中。同样,此方法无法用于体内环境。
流体动力传递可迅速且大量的(8~10% 体重)将含有组件的溶液推入动物的血液,通常使用小鼠的尾静脉,大量液体会导致流体动力压增加,从而暂时增强对细胞的渗透性,使通常无法穿过细胞膜的组件进入细胞,如 DNA 质粒和蛋白质。使用这种方法递送的组件在肝脏中明显富集。此方法在技术上很简单且不需要任何外源传递组件即可成功地将基因编辑组件引入细胞。
研究人员证使用流体动力学递送成功将编码 Cas9 和 sgRNA 的 DNA 质粒递送至肝细胞,从而在体内对遗传性酪氨酸血症小鼠肝细胞中的 Fah 突变进行了校正。尽管此方法取得了一些成功,但目前尚未临床应用,流体动力传递的过程是具有较大创伤性的,可能导致潜在的生理并发症,包括心脏功能障碍、血压升高和肝脏扩张,极易造成意外死亡,而且转染率非常低,并且仅适用于某些细胞类型的递送。
6.2 病毒载体的递送方法
■ 腺相关病毒(AAV)
AAV 是一种单链 DNA 病毒,已被广泛用于基因治疗,AAV 存在多种已知血清型,能感染具有不同特异性的多种细胞。CRISPR/Cas9 AAV 颗粒通常在 HEK 293 T 细胞中产生,合成的 AAV 可感染靶细胞系,使被感染的细胞能持续存在 CRISPR/Cas9 组件,基于 AAV 的基因传递方法可将传递的 CRISPR 基因整合到哺乳动物细胞的 AAVS1 基因座中。
Tabebordbar 等人使用两种不同的 AAV 载体分别通过肌内、眼眶后和腹膜内(IP)注射将 sp Cas9 和 sgRNA 递送至 DMD 模型出生后的 mdx 小鼠中,通过靶向敲除有缺陷的第 23 外显子以纠正 DMD 小鼠模型中突变的肌营养不良蛋白基因。但由于 AAV 的容量仅 4.7 kb,Cas9 基因的大小为 4.3 kbp。因此,必须使用两个单独的 AAV 载体分别递送 Cas9 基因和 sgRNA。
为了克服这种的限制,研究人员发现了较小的 Cas9 变体(如金黄色链球菌 Cas9,Sa Cas9),可以将编码 Cas9 和 sgRNA 的基因插入到单个载体中,但有研究发现 Sa Cas9 具有较高的免疫原性。
■ 腺病毒(AdV)和慢病毒(LV)
AdV 和 LV 是基因递送有效和广泛研究的载体,目前有超过 2,000 例相关的临床试验被批准。这两类病毒递送方式与 AAV 类似,其区别在于载体的大小。LV 和 AdV 的直径均约为 80~100 nm。与 AAV 的直径约 20 nm 相比,荷载量更大。
目前,许多研究使用 AdV 或 LV 载体来递送 CRISPR/Cas9 组件。有研究人员创建了独特的慢病毒 CRISPR/Cas9 系统,能使一个 Cas9 和四个不同的 sgRNA 在不同的启动子的控制下表达,以允许编辑几种不同类型的细胞。然而,AdV 和 LV 容易引起强烈的免疫应答。
有研究人员使用 Cas9 和 sgRNA 的 AdV 递送一种参与肝脏疾病的非酒精性脂肪性肝炎(NASH)基因,Pten。作用四个月后,经 Pten 基因编辑的小鼠表现出巨大的肝肿大和 NASH 特征。但是,除了在肝脏中显示与 AdV 载体相关的免疫毒性外,还检测到针对 SpCas9 的体液免疫,以及潜在的 SpCas9 特异性细胞免疫应答。
6.3 非病毒载体递送
■ 脂质纳米颗粒
脂质纳米颗粒已经被广泛用于输送载体,特别是递送核酸。核酸通常在细胞外部不稳定,并且由于它们带负电,不易穿过细胞膜。通过将核酸包裹在阳离子脂质体内,可以相对容易地被递送至细胞。脂质纳米颗粒可以最大程度地减少免疫原性,也可以像病毒颗粒一样,在体外,离体和体内使用。
传递 CRISPR/Cas9 系统时,有两种方法:传递 Cas9 和 sgRNA 遗传物质(质粒 DNA 或 mRNA)或传递 Cas9:sgRNA RNP 复合物。
但是脂质纳米颗粒递送 CRISPR/Cas9 系统也存在一定缺陷。首先,纳米颗粒一旦通过细胞表面,通常将其包裹在内体中。继而被细胞引导进入溶酶体降解。PEI 聚合物也已单独使用或与脂质体结合用于体内 Cas9 蛋白递送,以帮助诱导内体逃逸。同样,如果 Cas9:sgRNA 复合物可以逃脱内体,但也很难进入细胞核,因此,此方法的效率不高。
■ 无机纳米粒子
无机纳米粒子是天然的潜在 CRISPR 载体,包括 AuNP、CNT、MSNP、SiNP。与病毒和脂质/聚合物的载体相比,无机纳米粒子更易于大规模生产,更易于表征和化学功能化,并且随时间推移更稳定。此外还有很多其他方法,如 CPP、DNA 纳米线等都已经用于 CRISPR 系统的递送。
结语
近年来,CRISPR/Cas 基因编辑技术得到了飞速发展,并已广泛应用于许多领域,特别是在具有巨大潜力的医学领域。毫无疑问,将基于 CRISPR/Cas 的基因组编辑技术转化为医学应用会对人类健康产生重大影响,而此技术也引领了分子生物学工具的一场革命。
虽然 CRISPR/Cas 基因编辑技术存在一定局限性,但随着不同领域的大量研究人员积极投身该领域,势必在不久的将来 CRISPR/Cas 技术会发挥出它应有的光芒,服务人类健康。