心脏病干细胞治疗领域或被改写!Nature 重磅报道心脏干细胞疗法通过引发急性免疫反应帮助心脏再生的机制
二十多年来,医学界试图用骨髓源的干细胞和心脏内源性「c -kit+ 心肌干细胞」来治疗这一疾病。
不幸的是,2018 年 10 月中旬,c -kit+ 心肌干细胞的发现人、哈佛大学知名教授 Piero Anversa 被曝学术造假,其所建立起来的 c -kit+ 心肌干细胞的神话在一夜之间崩塌,多达 31 篇相关的论文被撤稿,这次事件为心脏病的干细胞疗法蒙上了巨大的阴影。
尽管心肌干细胞不存在,研究人员已经证明 c -kit+ 心肌间充质细胞和骨髓源干细胞的应用可以帮助心脏病病发后心脏再生。相关疗法已经在人体临床试验中被广泛研究和应用,并确定有一定正面效果,但其背后的生物学机制有待进一步研究。
2019 年 11 月 27 号,来自美国辛辛那提大学和霍华德・休斯医学研究所的 Jeffery D. Molkentin 教授领导他的团队在 Nature 上以「加快评审文章」(Accelerated Article Preview)的形式发表了题为《An acute immune response underlies the benefit of cardiac stem-cell therapy》的论文,首次报道了心脏干细胞疗法通过引发急性免疫反应来帮助心脏再生的机制。

图片来源:Nature
主要内容
研究人员主要研究了已经在临床试验中广泛使用的骨髓源单核细胞(bone marrow mononuclear cells,MNCs) 以及此前认为是心肌祖细胞(cardiac progenitor cells,CPCs)的 c -kit+ 心脏间充质细胞,与此同时,研究人员还使用了能诱发先天免疫反应的酵母聚糖(Zymosan)研究其能够影响心脏再生。
图片来源:Nature
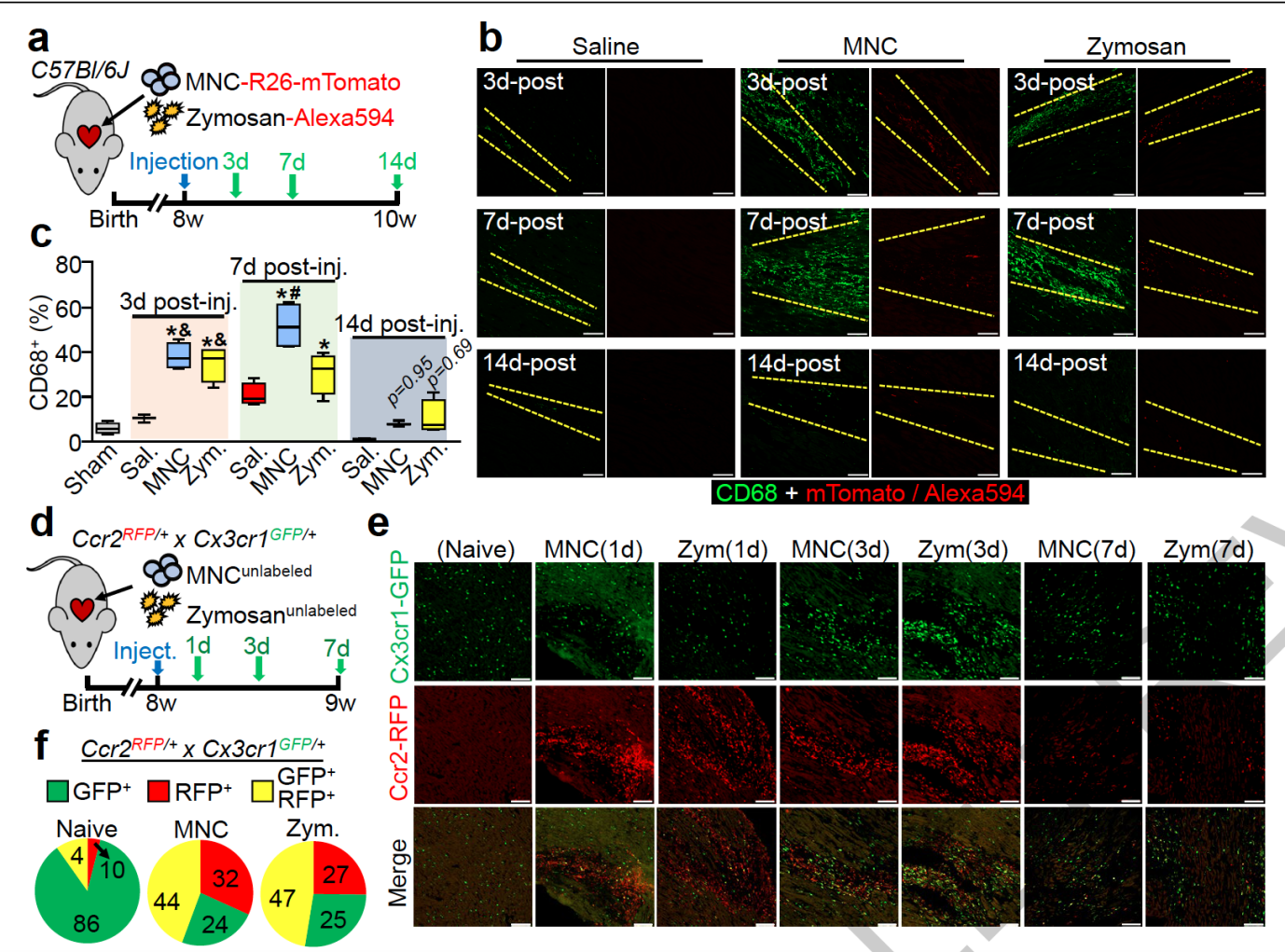
首先研究人员向 8 周正常小鼠的心脏注射了 MNCs、酵母聚糖和生理盐水。发现在注射后的第 3 天和第 7 天,注射位点发生了明显的免疫反应,出现了大量了 CD6 + 巨噬细胞。
为了进一步分辨巨噬细胞的亚型,研究人员用 GFP 和 RFP 分别标记了 CX3CR1 与 CCR2。
正常心脏中的巨噬细胞只有少量的 CX3CR1 +CCR2 - 巨噬细胞。在注射 MNCs 和酵母聚糖后,注射位点出现了大量 CCR2 + 阳性和 CX3CR1 +CCR2 + 巨噬细胞。而随着免疫反应的减轻,心脏中的巨噬细胞亚型又慢慢恢复为 CX3CR1 +CCR2 -。
这些数据表明,CX3CR1 和 CCR2 阳性的巨噬细胞可能与 MNCs 以及酵母聚糖的作用有关。
图片来源:Nature
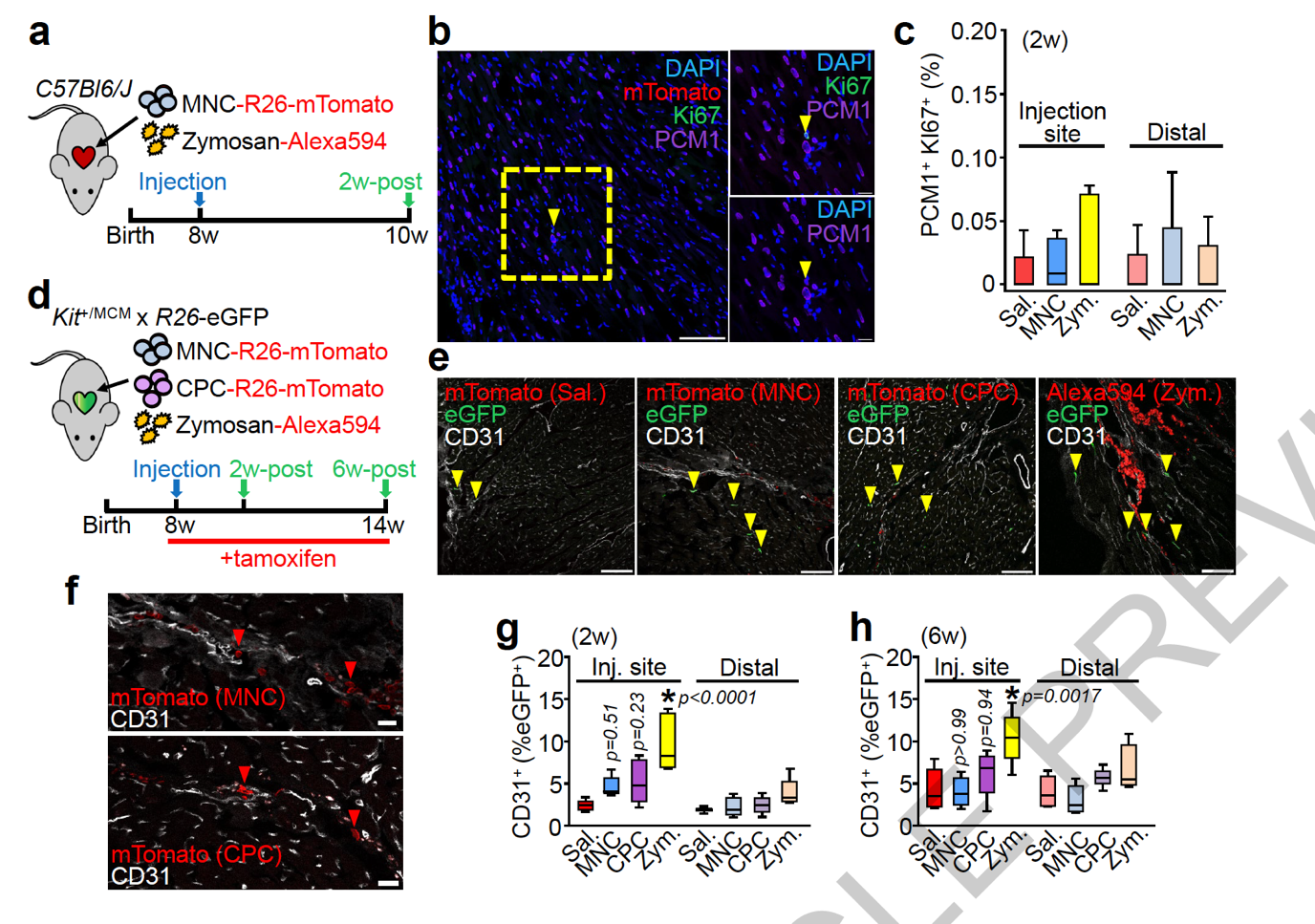
研究人员随后检查了 MNCs 和酵母聚糖能否促进心肌细胞增殖。但 Ki67 染色显示,MNCs 和酵母聚糖都不能显著影响心肌细胞的增殖。
所有心肌细胞的增殖率都非常低,Ki67 阳性率低于 0.1%,证明相关细胞疗法并不能促进心肌细胞增殖。
另一方面,MNCs 和 CPCs 都不能增加血管内皮细胞的数量,反而酵母聚糖显著提高了血管细胞的数量。除了心肌细胞增殖和血管内皮细胞的数量,MNCs 和 CPCs 都无法分化成为心肌细胞和血管内皮细胞。
图片来源:Nature
在研究了往正常小鼠中注射 MNCs, CPCs 和酵母聚糖的作用后,研究人员终于开始在心脏病模型中研究干细胞疗法的作用。
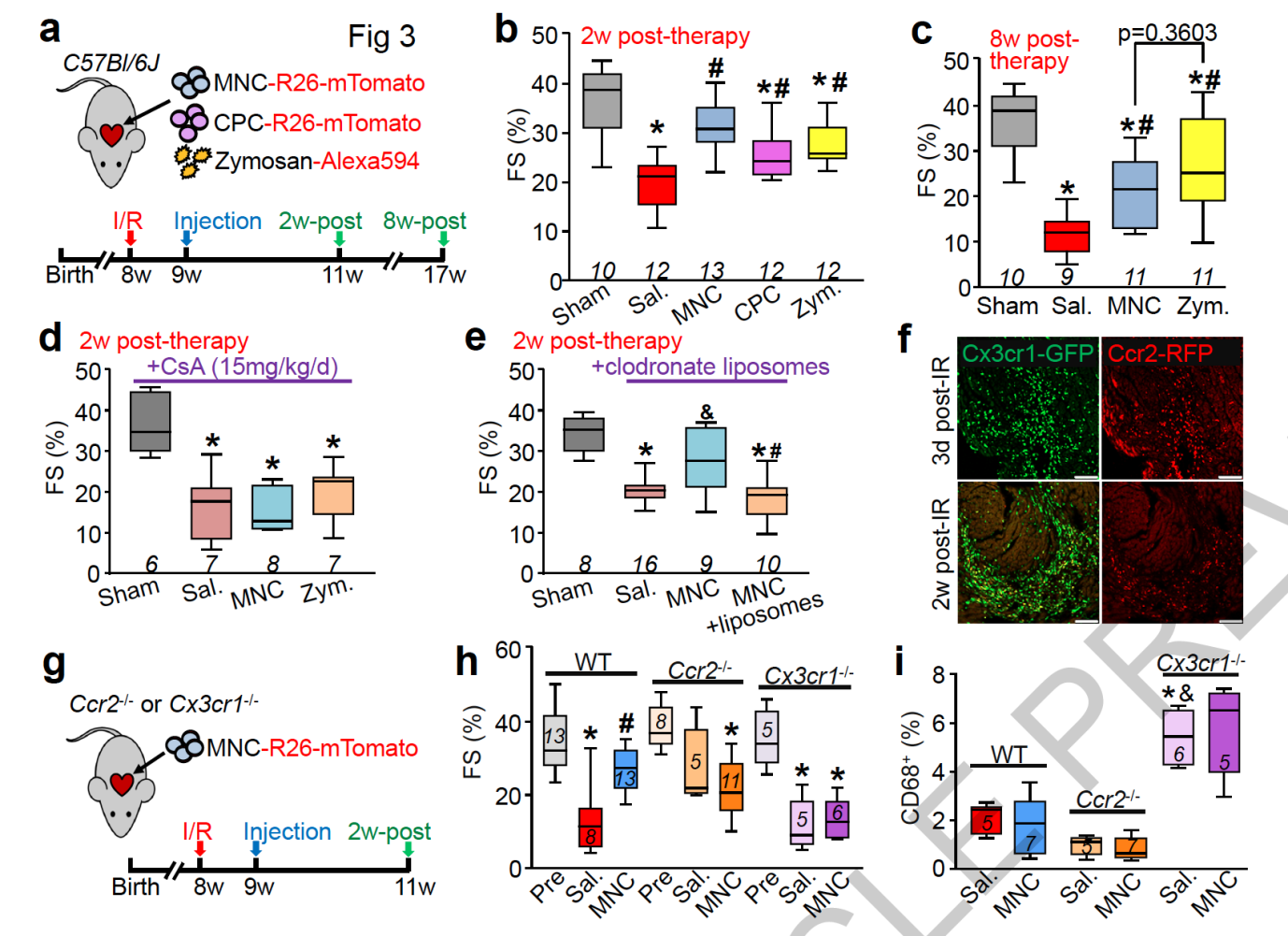
在对小鼠进行心脏缺血再灌注模拟缺血性心脏病后一周,研究人员向心脏上的伤口边缘注射了 MNCs, CPCs 和酵母聚糖。与对照组相比,三个实验组的心室功能在 2 周和 8 周后出现了明显的改善。
免疫抑制剂 Cyclosporine A 和用氯膦酸二钠脂质体都能显著降低 MNCs 和酵母聚糖的治疗功能,说明这几种疗法的治疗作用与巨噬细胞相关的免疫效应有关。
心脏缺血再灌注能显著增加受损部位 CCR2 和 CX3CR1 巨噬细胞的数量,而在敲除这两种基因后,MNCs 对心室功能的改善作用也完全消失,证明起治疗作用的巨噬细胞与 CCR2 和 CX3CR1 有关。
值得注意的是,尽管 CCR2 敲除的小鼠在心脏受损后巨噬细胞总数出现了下降,CX3CR1 敲除明显提高了心脏巨噬细胞的数量。研究人员将这归咎为 CX3CR1 通过影响巨噬细胞的功能而不是数量来调节 MNCs 导致的心脏再生。
图片来源:Nature
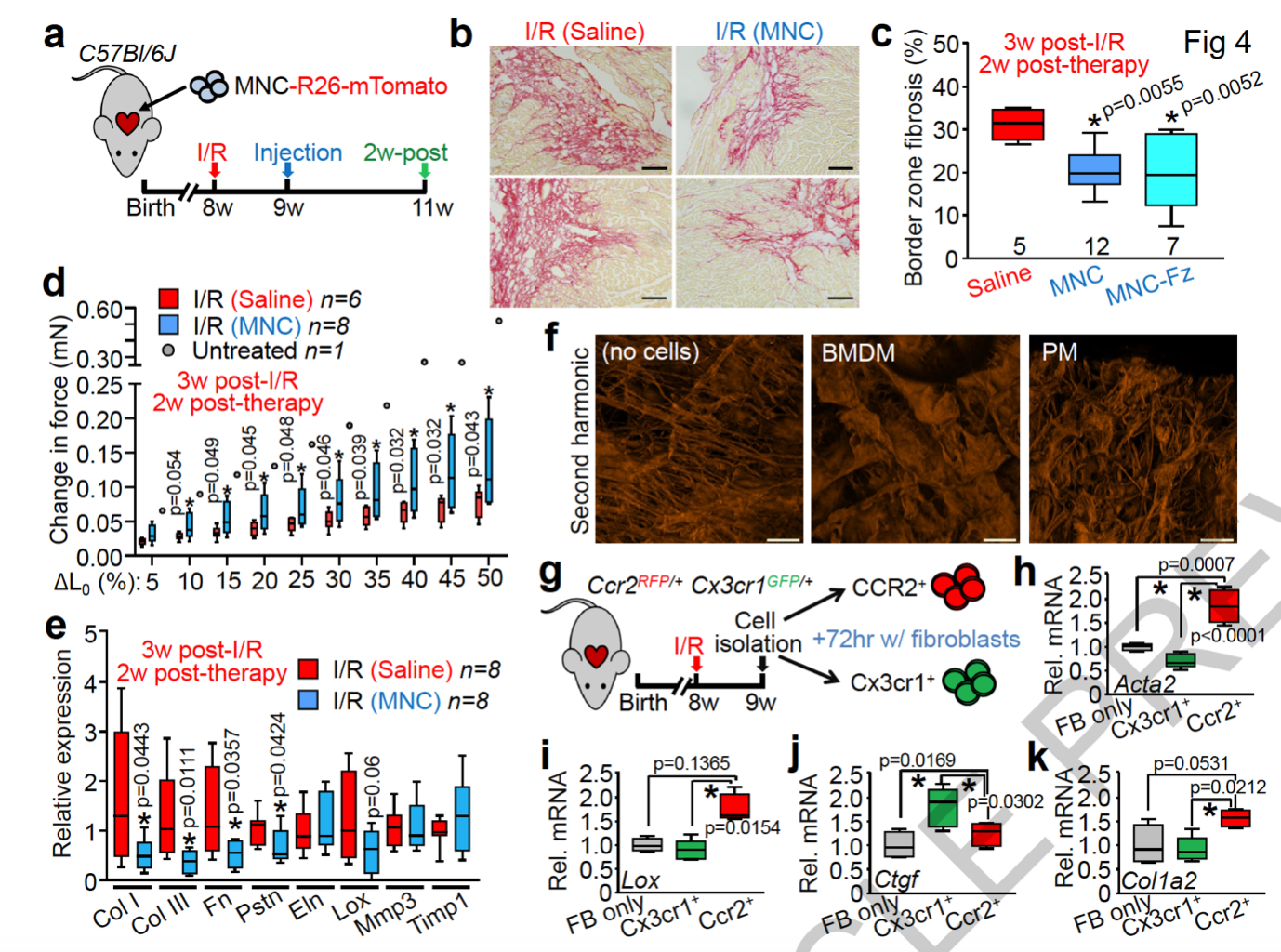
为了进一步探究细胞疗法改善心脏功能的机制,研究人员分析了小鼠心脏中的细胞外基质组成,发现了接受 MNCs 治疗的小鼠在受损部位周边有更少的细胞外基质。而过多细胞外基质造成的心脏纤维化是心脏功能下降的主要原因。
令人吃惊的是,当研究人员注射因为冷冻而不能存活的死 MNCs 后,他们观测到了相似的表型,意味着 MNCs 导致的心脏功能改善和它们的旁分泌因子无关。这直接说明了 MNCs 相关的疗法是通过与旁分泌无关的机制改善心脏功能。
与此同时,MNCs 治疗也能显著改善心脏损伤所导致的被动回缩力(passive force)下降。
作者然后进一步证明了 CX3CR1 + 和 CCR2 + 巨噬细胞能够调节心脏纤维化细胞中纤维化基因的表达,意味着 MNCs 等细胞疗法引发的免疫反应导致的 CX3CR1 + 和 CCR2 + 巨噬细胞聚集能够通过调节心脏纤维细胞的细胞外基质分泌来改善心脏的被动力学性质,最终到达改善心脏功能的目的。
亮点分析
本研究以「加快评审文章」的形式在 Nature 发表证明了它的重要性,它很有可能会改变价值数十亿美元的心脏病干细胞疗法的方向。
在心肌干细胞丑闻爆发之前,学界认为 MNCs 和 CPCs 可以分化为心肌细胞和心脏血管内皮细胞改善心脏功能,并以此为依据开展临床实验。
尽管很多临床实验表现出显著的改善作用,随后的研究中发现成体心脏中并不存在能够直接分化为心肌细胞的心肌干细胞,这是心脏病干细胞治疗领域十多年最大的污点。
在心肌干细胞事件之后,学界愈发倾向于 MNCs 和 CPCs 的旁分泌功能是导致心脏功能盖上的主要原因,但在该论文中依旧被推翻。
因为作者证明不具备细胞活性的死 MNCs 细胞也能改善心脏功能,而能够诱发先天免疫反应的酵母聚糖有着比 MNCs 更强和更持久的效果。
通过使用细胞谱系的方法,研究人员证明了免疫反应带来的 CX3CR1 + 和 CCR2 + 巨噬细胞是导致心脏功能改善的主要原因,并说明了 CX3CR1 + 和 CCR2 + 巨噬细胞通过调节心脏纤维化改善心脏功能的机制。
尽管该研究在心脏纤维细胞方面的机制研究还不够深入,但目前得到的结论已经足以影响整个领域。
干细胞相关的治疗价格高昂,该研究再一次证明了干细胞不能在体内分化为心肌细胞。其治疗效果并不是来源于干细胞本身的分化和旁分泌效应,而是其诱导的免疫反应。
这意味着通过调节心脏的免疫反应就可能达到干细胞的治疗效果。能诱发免疫反应且廉价易得的化合物将有可能被直接用来治疗心脏病。
前期研究
本文的通讯作者 Jeffery D. Molkentin 是心血管领域的权威学者,一直致力于加快心脏病疗法的研发进程,同时也力图让心脏病疗法的研发少走弯路。
在心肌干细胞事件中,他是第一个使用严格的遗传实验在 2014 年证明 c -kit+ 心肌干细胞不能分化为心肌细胞的学者,也是直接导致心肌干细胞造假事件曝光的主要推手。

图片来源:PMC
在 2014 年这篇发表在 Nature 的研究中,Jeffery D. Molkentin 带领团队使用了严谨的细胞谱系体内示踪技术证明所谓的 c -kit+ 心脏干细胞无法分化成心肌细胞,该结论随后被包括中科院周斌研究员等多所实验室分别证明。
在 2018 年心肌干细胞事件正式曝光之前,Jeffery D. Molkentin 在 Circulation 发表文章一锤定音,以坚定的口吻声明内源性成体心肌干细胞并不存在。

图片来源:Circulation
在此之后,学界将重心转向相关骨髓干细胞和 c -kit+ 心肌间充质细胞的旁分泌效果,以此作为价值数十亿美元的心脏病干细胞疗法的理论基础。但 Jeffery D. Molkentin 并没有停止自己的脚步,他试图进一步验证旁分泌因子理论的可靠性。
本次研究用死细胞和酵母聚糖达到了和细胞疗法相似,甚至是更强的治疗效果,证明了细胞疗法的干细胞与旁分泌因子的关系并不大,心脏病干细胞疗法的理论基础再一次被改写。
整个心脏病的干细胞疗法可谓一波三折,但 Jeffery D. Molkentin 在里面总是扮演着关键角色。也是因为他,我们也离真相越来越近了。
参考文献:
1. Vagnozzi, R.J., Maillet, M., Sargent, M.A. et al. An acute immune response underlies the benefit of cardiac stem-cell therapy. Nature (2019) doi:10.1038 /s41586 - 019 - 1802 - 2
2. van Berlo JH, Kanisicak O, Maillet M, et al. c-kit+ cells minimally contribute cardiomyocytes to the heart. Nature. 2014;509(7500):337–341. doi:10.1038 /nature13309
3. Maliken BD, Molkentin JD. Undeniable Evidence That the Adult Mammalian Heart Lacks an Endogenous Regenerative Stem Cell. Circulation. 2018;138(8):806–808. doi:10.1161 /CIRCULATIONAHA.118.035186








