合作专家 | 李煜钰博士
病理学与病理生理 首都医科大学
审核专家 | 聂壹峰博士
纳米生物医学 中国科学院大学
简介
Evans Blue 染色是的用途非常广泛,在小动物的活体实验中涉及到心血管系统、神经系统、骨骼肌系统等疾病的研究,这里我们主要介绍了 Evans Blue 染色联合 TTC(2, 3, 5-氯化三苯基四氮唑)来区分小鼠心脏缺血再灌注损伤后危险区及梗死区。
原理
通过构建小鼠的心脏缺血再灌注损伤模型(I/R 模型),小鼠心脏受损后可分为以下三个区域:
(i)非缺血区;(ii)危险区(area at risk,AAR 区)(iii)梗死区(Infarct size,IS 区)。
Evans Blue 是一种常用的实验方法,用于观察心肌梗死区域和未受损区域,属于一种水溶性荧光染料,能够进入损伤的心肌细胞并结合到细胞膜上,形成蓝色颜色,因此 Evans Blue 主要着色区域为非缺血区,呈蓝色。
TTC 属于一种氧化还原指示剂,能够被心肌细胞中的酶反应还原为红色物质,可以用于观察心肌细胞完整性,只有代谢活动较强的心肌细胞才会呈现红色。因此主要着色区域为梗死区,为白色,而危险区不会被染色,呈现原有的心肌颜色,为红色。
用途
Evans Blue + TTC 双染色法是一种组合技术,可以同时观察心肌细胞完整性和代谢活动,心脏 Evans Blue + TTC 双染色主要用于评估小鼠心脏缺血再灌注损伤模型中危险区和梗死区面积的相对大小,将心脏损伤后受损程度可视化,从而进行心肌梗死区域的定位和分析。
材料与仪器
已构建 I/R 模型的小动物(小鼠、大鼠等)
1.5% Evans Blue 染液、1% TTC 染液
麻醉剂、刀片、1 mL 注射器、眼科剪
镊子、7-0 带线缝合针、止血钳
选用:小动物呼吸机
步骤
1、配制 1.5% 的 Evans Blue 染液(1.5 g + 100 mL 双蒸水)、1% TTC 染液备用。
2、用麻醉剂麻醉小鼠(这里麻醉剂不做推荐,根据小鼠体重选择合适的剂量)。
3、将小鼠开胸,迅速在小鼠心脏前降支血管原结扎位置处用 7-0 带线缝合针进行结扎(有条件的可以使用小动物呼吸机协助)。
4、用止血钳小心将升主动脉钳夹,从钳夹处近心端小心缓慢注射 Evans Blue 染液(25 g 小鼠约 0.2 mL)可观察到小鼠心脏迅速变蓝,结扎线以下变化不明显。
5、迅速分离出心脏后置于 -20 或 -80 ℃ 冰箱保存。
6、按以上步骤收集完所有心脏后,从冰箱中取出心脏,用刀片从心尖部逐层切片,每片约 1 mm 厚(小鼠),切 5~6 片。
7、将切好的心脏片置于 TTC 染液中避光染色约 10~20 分钟,取出后在体式显微镜下进行拍照。
8、利用 ImaginJ 软件上进行统计定量分析。
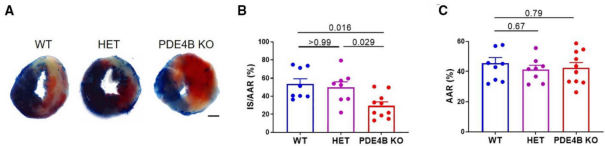
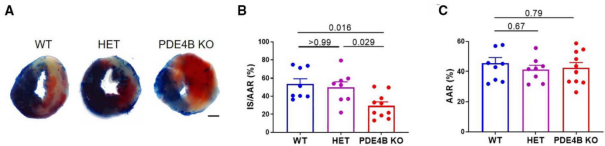
Circ Res. 2022 Aug 19;131(5):442-455. doi: 10.1161/CIRCRESAHA.122.321365. Epub 2022 Jul 28.
图 A 中,小鼠心脏切片非缺血区呈蓝色,梗死区为白色,而危险区不会被染色,呈现原有的心肌颜色,为红色。图 B 为各组梗死区所占危险区的百分比。图 C 为各组危险区的百分比。
注意事项
1. Evans Blue 染液和 TTC 染液都最好提前计算好用量,现配现用。
2. 小鼠不可麻醉过量,以防心脏骤停。
3. 小鼠在开胸后,要尽快完成前降支结扎,且要和构建模型过程中结扎位置一致。
常见问题
1. 没有小动物呼吸机辅助怎么办?
该实验不依赖于小动物呼吸机,有的话更好,可以延长开胸后小鼠心脏跳动时间,没有小动物呼吸机也是可以完成的,只是需要在开胸后,尽快完成前降支结扎,主动脉钳夹,注射 Evans Blue 染液等操作。
2. 在注射 Evans Blue 染液的过程中,发现心脏没有明显变蓝而肝脏及胃肠道变蓝是什么情况?
这是由于没有进行主动脉钳夹或主动脉钳夹不完全造成的,大量的 Evans Blue 会通过主动脉进入肝脏及胃肠道,而几乎不能进入冠状动脉所引起的,此时应该及时进行完全钳夹主动脉后,再进行下一步的染液注射。
来源:丁香实验