合作专家 | 薛梦瑶博士
植物病理学 中国农业大学
审核专家 | 于涛博士
生物化学分子生物 中国科学院大学
简介
利用特定标记蛋白比如绿色荧光蛋白(GFP)或 β-葡萄糖苷酸酶(GUS)标记目的蛋白,随后通过免疫荧光或者 GUS 染色检测其分布位置。
原理
目前最常用的是融合报告基因定位,将目的蛋白与荧光蛋白的 N 端或者 C 端融合,通过瞬时转化或稳定遗传转化技术,使该融合蛋白在受体细胞中表达,目的蛋白与荧光蛋白一起定位到目标细胞器。随后在共聚焦显微镜的激光照射下,融合蛋白会发出特定颜色的荧光,从而精确地定位目的蛋白质的位置。
用途
借助亚细胞定位,可以判断蛋白质或其表达产物在细胞中的具体位置,为研究基因的作用机制提供研究方向,如与酵母双杂相互验证来研究蛋白互作等。
材料与仪器
本实验方法以借助 GFP 在水稻中的定位为例进行介绍:
1、载体和植物材料:PAN580-GFP 载体、籼稻 9311 的种子等;
2、主要试剂:甘露醇、MES、纤维素 R-10、Macerozyme R-10、BSA、羧卞青霉素、β-ME、PEG 4 000、CaCl2、NaCl、KCl、MgCl2、葡萄糖等;
3、所需用品和仪器:50 ml 离心管、50 ml 注射器、刀片、尼龙滤布(200 目)、0.45 μm 微孔滤膜、血球计数板、载玻片、盖玻片、低温离心机、真空泵、分光光度计、激光共聚焦显微镜等。
步骤
0. 试剂配制
1) 酶解液(10 ml)
|
0.6 M 甘露醇 |
1.093 g |
|
10 mM MES(pH=5.7) |
1 ml(100 mM 母液) |
|
1.5% 纤维素 R-10 |
0.15 g |
|
0.75% Macerozyme R-10 |
0.075 g |
|
0.1% BSA |
0.01 g |
|
1 mM CaCl2 |
0.1 ml(100 mM 母液) |
|
0.25 g/ml 羧卞青霉素 |
2 μl |
|
β- ME |
4 μl |
ddH2O 定容至 10 ml,55 °C、10 min 自然冷却(须现配现用)。
2) PEG 4000(10 ml)
|
0.6 M 甘露醇 |
1.093 g |
|
100 mM CaCl2 |
0.111 g |
|
40% PEG 4000 |
4 g |
ddH2O 定容至 10 ml,1M KOH 将溶液 pH 值调至 7.5~8.0,过滤除菌后 1.5 ml 离心管分装后保存在 -20 °C 冰箱中。
3) W5(100 ml)
|
154 mM NaCl |
0.9 g |
|
125 mM CaCl2 |
1.39 g |
|
5 mM KCl |
5 ml(100 mM 母液) |
|
5 mM 葡萄糖 |
0.09 g |
|
2 mM MES |
2 ml(100 mM 母液) |
1M KOH 将溶液 pH 值调至 5.8,高温高压灭菌 20 min,室温保存。
4) MMG(10 ml)
|
15 mM MgCl2 |
1.5 ml(100 mM 母液) |
|
4 mM MES |
0.4 ml(100 mM 母液) |
|
0.6 M 甘露醇 |
1.093 g |
1M KOH 将溶液 pH 值调至 5.8,高温高压灭菌 20 min,室温保存。
1. 目的蛋白预测
目的蛋白的定位可以通过一些在线网站进行预测,在此推荐几个植物常用的预测网站:
WoLF PSORT: Protein Subcellular Localization Prediction Tool(genscript.com)
iPSORT Home Page(hgc.jp)
Services list(dtu.dk)
TargetP 2.0 - DTU Health Tech - Bioinformatic Services
2. 构建包含目的基因的载体
本实验所用的载体为带有 GFP 标签的 PAN580 载体,其载体图如下图所示:
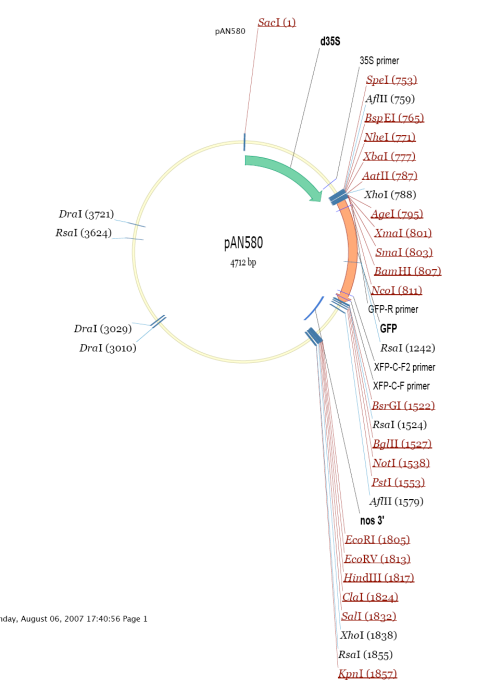
载体构建方法为双酶切+同源重组(基因在 GFP 上游的引物设计时需要去除终止密码子),测序无误后大提质粒,最终质粒浓度应在 1 000 ng/ul 以上,建议不低于 800 ng/ul。
3. 水稻种植
挑选外观饱满、大小一致的籼稻 9311 种子若干,30 ℃ 下浸种 2 天,催芽 12 h 后播种,在 10 h 光照/14 h 黑暗、28 °C、光照强度为 10 000 lx 的光照培养箱中培养数日至苗长高至 10 cm 左右。
4. 原生质体提取
1) 幼苗连根拔起,切去根部并清洗干净,从根基开始,选择白色坚实的茎部分,切成尽可能短的小段,称重后倒入干净的 100 ml 锥形瓶中,1 g 幼苗小段加入 10 ml 酶解液;
2) 抽真空 45~60 min,28 ℃、40 rpm 培养箱中震荡培养 4~5 h(注意避光);
3) 尼龙膜(200 目)过滤酶解液至灭菌的 50 ml 离心管内,置于 28 ℃ 培养箱中备用;
4) 滤渣中加入 10 ml W5 溶液,28 ℃、80 rpm 培养箱中震荡培养 1 h,充分释放原生质体;
5) 再次用尼龙膜(200 目)过滤,与步骤 3 中的滤液充分混合,并加入等体积的 W5 溶液,150 g 室温离心 5 min(升降速均选择轻柔模式),弃上清;
6) 加入 1 ml 重悬液重悬后,缓慢加入 20 ml 20% 蔗糖溶液,使原生质体悬浮于蔗糖溶液中,120 g 离心 5 min(升降速均选择轻柔模式);
7) 收集分层界面处的原生质体,W5 溶液洗净后,冰上孵育 30 min,以 100 g 离心 5 min 沉淀原生质体,弃上清,尽可能去除残留液体后,轻轻加入 1 ml MMG 溶液重悬原生质体,显微镜下将原生质体密度调整为 2×105 cells/ml。
5. 质粒转化与观察结果
(1) 在灭菌的 2.0 ml EP 管中加入 10 μl(10~20 μg)包含目的片段的重组质粒,小心加入 150 μl 原生质体,轻摇混匀;
(2) 加入 150 μl 40% PEG,轻摇混匀,28 ℃ 培养箱中孵育 20 min;
(3) 缓慢加入 500 μl W5 溶液,小心混匀,150 g 离心 4 min(注意离心管的摆放方向),枪尖吸除 PEG;
(4) 缓慢加入 100 μl W5 溶液重悬,28 ℃ 培养箱中黑暗培养 12 h 以上;
(5) 激光共聚焦显微镜下观察荧光蛋白的表达情况。
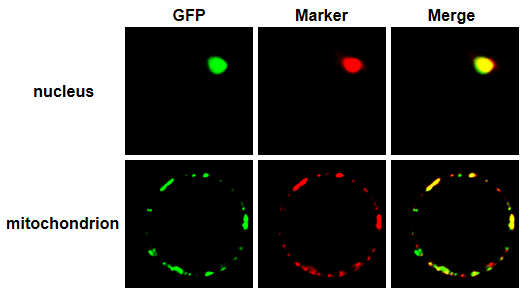
下图为本实验室所研究的细胞核定位和线粒体定位的两个蛋白质在水稻原生质体中的定位情况。本图仅供学习交流。图所示:
注意事项
1、构建载体时需要注意 GFP 标签的融合位置,若目的序列中存在信号肽,构载体时需避开这一端来融合荧光蛋白,因为不同的融合方式可能会观察到不同的定位情况,影响实验结果;
2、不同物种的表达情况会稍有差别,所以会出现不同受体物种中的定位不同的情况,在选择受体时,应尽量选择与目的蛋白或基因的序列来源相近的物种材料(如水稻蛋白常选在水稻、洋葱表皮和烟草中进行);
3、建议提供 GFP 空载作为空白对照,证明该荧光蛋白在实验中能够正常行使功能,同时排除实验操作中目的蛋白受荧光信号的影响;
4、建议增设一个明场通道,说明原生质体是活性状态良好的活细胞,同时说明荧光信号是由融合蛋白而非细胞碎片产生的。
5、本实验所用的 PAN580 载体上携带有 35 S 强启动子,建议同时构建基因自身启动子融合 GFP 的载体,避免定位结果受到基因表达水平的干扰。
常见问题
1. 水稻原生质体得率和活率较低:原生质体得率低可能是酶解液未能很好的接触植物切口,如水稻茎段不易浸入酶解液中,因此要切成尽可能的小段以及通过抽真空的方式增大酶解液与切口的接触面积、促进酶解液进入植物组织;原生质体活率较低可能是操作过程中避光不严密所致,光照会会原生质体膜造成伤害,导致其活率较低。
2. 观察不到荧光:不同物种的细胞可能对基因表达存在不同的影响,建议更换受体材料来观察荧光,如烟草等。
来源:丁香实验