合作专家 | 江佳红硕士
生物物理学 大连海事大学
审核专家 | 张望博士
感染病学 浙江大学
原理
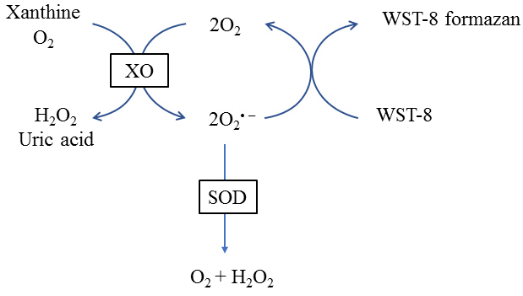
SOD 是一种广泛存在于生物体内的金属酶,是重要的氧自由基清除剂,能催化超氧化物阴离子发生岐化作用,生成 H2O2 和 O2。
SOD 不仅是超氧化物阴离子清除酶,也是 H2O2 主要生成酶,在生物抗氧化系统中具有重要作用。通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子(O2-),与 WST-8 反应生成水溶性紫色甲臜;SOD 可清除 O2-,从而抑制了甲臜的形成;反应液紫色越深,说明 SOD 活性愈低,反之活性越高。
用途
检测样品中 SOD 的活性。
材料与仪器
SOD 测定试剂盒、60 mm 平皿
1.5 mL 离心管
步骤
A. 样品制备
1. 样品收集
整个方案使用 L4 期线虫作为参考点。用 1.6 mL 磷酸盐缓冲盐水(PBS, pH 7.0)将每个线虫生长平板上的 L4 期线虫洗到 1.5 mL 离心管中。
在 4 ℃ 下,重力沉降 30 min 后,小心地移出并丢弃上清。加入 500 μL 预冷的 PBS,温和重悬沉淀,然后进一步沉降 15 min。然后,丢弃上清,加入 500 μL 预冷的 PBS,轻柔重悬,根据以下步骤在 200 μL PBS 的离心管中获得有 20、50、100、200、300、400 和500 个线虫的群体。
以 100 个线虫的群体为例:
a. 在显微镜下计数 20 μL PBS 中的线虫,分别进行 3 次独立试验,估计整个试管内的线虫密度。
b. 根据获得的线虫数量,计算和调整 PBS 的体积,使最终密度为每 20 μL 9~11 条线虫。例如,如果数字大于 10,则相应地添加更多 PBS;如果数量小于 10,则进行 10 min沉降,并去除相应量的 PBS 以达到所需的密度。
c. 用移液管将 260 μL PBS 与线虫转移到新的 1.5 mL 管中,并轻柔重复重新悬浮沉淀。
d. 在三个独立试验中计数 20 μL PBS 中的线虫数量,中间温和重复移液,以确认线虫密度,在管中留下 200 μL。如果线虫密度与设置不一致,请重复步骤 A1b。
通过相同的方式准备具有其他线虫样本。
2. 样品存储
将样本在 5000 xg 下离心 5 min(4 ℃)。用移液器小心移除上清,将沉淀存放在 -20 ℃(过夜)或 -80 ℃(可保存一周以上)。
3. 样品均质化
a. 在冰上将离心管中的颗粒进行研磨。
b. 在 4 ℃ 下,5000 xg 离心 5 min。吸出 200 μL 上清液。分装于四管中,每管 50 μL,用于后续测定。
B. SOD 活性测定
1. 根据 ELISA 试剂盒说明书准备标准品、对照和工作液
a. 每个样品需要 160 μL WST-8/酶工作液和 20 μL 反应液。根据线虫样本数和标准品数量计算总量。对于 WST-8/酶工作液,160 μL 由 151 μL SOD 检测缓冲液、8 μL WST-8 和 1 μL 酶溶液组成。
b. 将原液 1:40 稀释至 SOD 检测缓冲液中(即 1 μL 原溶液至 39 μL 缓冲液),制备反应液。
2. 样品的测定
a. 在 96 孔板中加入 20 μL 标准品和对照,至少设置 2 个复孔。
b. 在 96 孔板中加入 20 μL 线虫样品,至少设置 2 个复孔。值得注意的是,在样品均质步骤后,每个线虫样品都经过处理并分成 4 份,避免样品的重复冷冻解冻。
c. 用多通道移液器在每个样品中加入 160 μL WST-8/酶工作液,然后加入 20 μL 反应液。标准品浓度分别为 100、50、10、5、2.5、1.25、0.625 U/mL。
d. 有两个空白对照。空白对照1 用 SOD 检测缓冲液替代 20 μL 样品。空白对照2 用 40 μL SOD 检测缓冲液代替 20 μL 样品和 20 μL 反应液。
e. 37 ℃ 孵育 30 min。
f. 用酶标仪读取 450 nm 处的吸光度(A450)。
3. SOD 活性测定的计算
a. 抑制度(%) = (空白对照1 - 标准品或样品) / (空白对照1 - 空白对照2)× 100%。用已知 SOD 活性及其抑制作用的标准品建立标准曲线。然后,利用曲线计算样品的 SOD 活性。
b. 将每个样本的总蛋白浓度作为内参,以消除样品间线虫数量的差异,标准化 SOD 活性表示为实测 SOD 活性与该样本总蛋白浓度的比值。
下表列出了线虫体内标准化的 SOD 活性,比值一般在 4.04~4.35 之间,然而 20 和 50 个线虫/组的数值比一般范围大得多。因此要保证 SOD 活性测定的可行性和稳定性,至少需要使用 100 个线虫/组。

4. 数据分析
a. 每个样本至少检测 3 个等分,每个等分至少设置 3 个检测复孔,测定每个复孔线虫总蛋白(TP)值,并计算每个等分的 TP 均值以表示样品中的 TP 浓度。计算每个复孔的 SOD 值与 TP 均值的比值,得到样品中的 SOD 活性。
b. 如果样品来自不同处理,则将对照组中标准化的 SOD 活性归一化为 100%(或 1.0);然后,处理组中的标准化的 SOD 活性转化为对照组的百分比(POCs)(或对照的倍数变化);然后,使用样本中的 POC 值(或 fold-change)计算平均 POC。
注意事项
1. 当从生长平板收集线虫时,虫浆中的细菌会对测定造成干扰。因此,不使用离心,而是使用重力沉降进行样品收集。为了完全去除细菌,轻轻清洗沉淀(即重悬 - 沉降 - 丢弃上清液)几次。
2. 为了确保可重复性,每个试管中应至少有 100 个线虫。
3. 来自 100 个线虫的均质 PBS 溶液的上清液足以用于四个等分试样,这足以用于包括总蛋白浓度在内的四个生化测定。如果同时进行更多的生化测定,线虫数量应该增加。
来源:丁香实验