简介
热不对称 PCR 是传统的引物浓度不对称 PCR 的发展,它利用一对引物的碱基数目与组成不同,造成退火温度的差异而实现。
原理
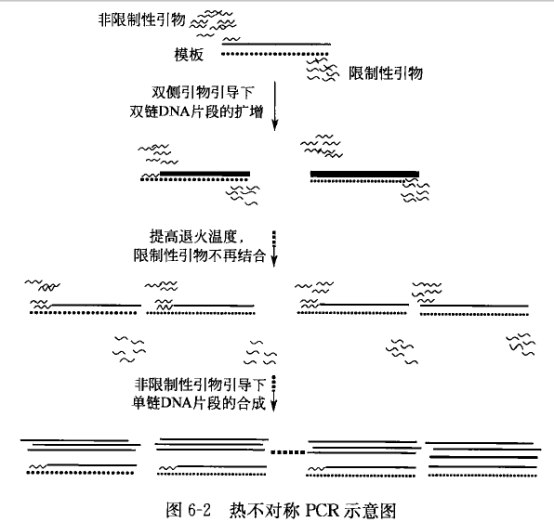
常规热不对称 PCR 是的基本原理是利用一对引物的碱基数目与组成不同,造成退火温度的差异而实现。设计引物时两引物的退火温度可以根据常用的软件进行分析,也可以根据退火温度的常用计算公式:L = 69.3 + 0.41[(G + C)mol%] — 650/L(L=引物长度)计算,设计的限制性引物与非限制性引物的退火温度应相差 10 °C 以上,其中限制性引物的退火温度低于非限制性引物的退火温度,在最初的 10~15 个循环中使用较低的退火温度(根据限制性引物的退火温度决定,一般略低于限制性引物的退火温度),这时变性后两引物都可以与模板结合,引导 DNA 链的合成,产生双链产物,随后将 PCR 的退火温度提高(根据非限制性引物的退火温度决定),此时限制性引物不能再与模板发生退火,只有非限制性引物可以与模板结合后继续引导扩增,从而产生大量单链 DN。其具体过程如图 6-2 所示。
材料与仪器
步骤
常规热不对称 PCR 的基本过程可分为如下几步:
热不对称 PCR 的反应体系与常规 PCR 相同,总体积 100/μL 反应体系含有:

A. 94 °C , 预变性 1~2 min,随后进行第一个阶段 10 个循环,每一循环 94 °C 1 min,50 °C 1 min,72 °C 1 min。
B. 然后紧接着进行第二阶段的 20 个循环,每一次 94 °C 1 min,70 °C 1 min,72 °C 1 min,循环结束后 72 °C 延伸 7 min。
C. PCR 结束用 1% 的琼脂糖凝胶电泳常规分析产物。
来源:丁香实验








