不对称PCR实验
最新修订时间:
简介
Gyllensten 等在 20 世纪 80 年代末发明了一种新的方法扩增单链的 DNA用于 DNA 的序列测定,这就是不对称 PCR (asymmetric polymerase chain reaction),它指的是利用不等量的一对引物来产生大量的单链 DNA (ssDNA) 的方法。
目前,用于不对称 PCR 实验的方法主要有 3 种:引物浓度不对称 PCR、常规热不对称 PCR 和交错式热不对称 PCR。
原理
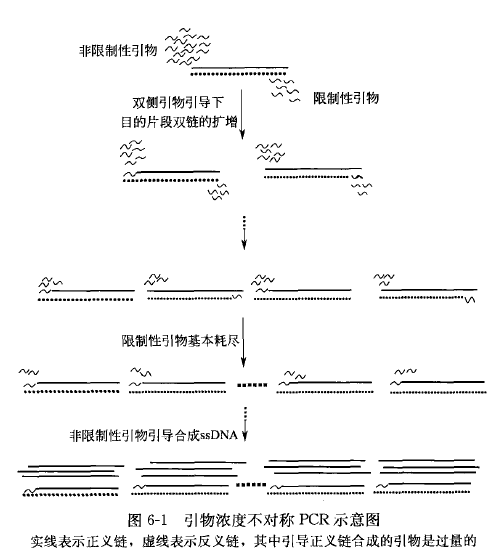
引物浓度不对称 PCR 的基本原理是通过不等量的一对寡核苷酸引物引导扩增得到大量单链 DNA 的反应,在不对称 PCR 中限制性引物与非限制性引物在每一反应中的摩尔物质的量浓度相差悬殊,其最佳比例一般是 1 : 50~1 : 100,关键是限制性引物的绝对量。在扩增反应的开始 10~15 个循环中,两引物都与模板发生退火,引导 DNA 链的合成,所以全部产物都是双链 DNA, 而且几乎是以指数速率扩增,在 12~15 个循环以后,其中的限制性引物的浓度降低,甚至基本耗尽,从而制约了反应的进行,双链 DNA 的合成速率显著下降,此时非限制性引物将继续引导单链 DNA 的合成,故反应的最后阶段只产生初始 DNA 中一条链的拷贝(非限制性引物引导合成的单链),随后的合成和变性过程中仅单链产物以线性速率扩增。其具体过程如图 6-1 所示。
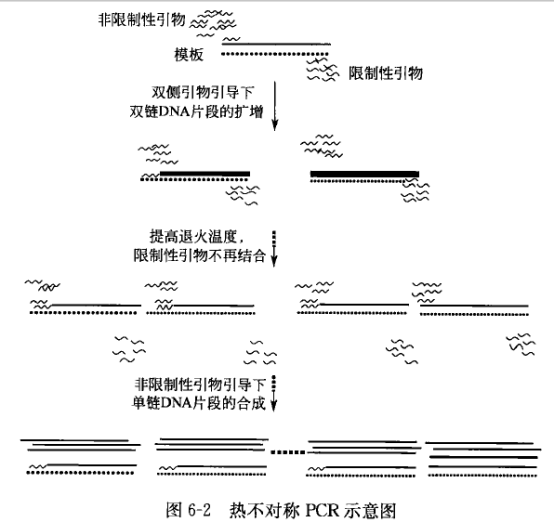
常规热不对称 PCR 是的基本原理是利用一对引物的碱基数目与组成不同,造成退火温度的差异而实现。设计引物时两引物的退火温度可以根据常用的软件进行分析,也可以根据退火温度的常用计算公式:L = 69.3+0.41[(G+C)mol%] — 650/L(L=引物长度)计算,设计的限制性引物与非限制性引物的退火温度应相差 10 °C 以上,其中限制性引物的退火温度低于非限制性引物的退火温度,在最初的 10~15 个循环中使用较低的退火温度(根据限制性引物的退火温度决定,一般略低于限制性引物的退火温度),这时变性后两引物都可以与模板结合,引导 DNA 链的合成,产生双链产物,随后将 PCR 的退火温度提高(根据非限制性引物的退火温度决定),此时限制性引物不能再与模板发生退火,只有非限制性引物可以与模板结合后继续引导扩增,从而产生大量单链 DN。其具体过程如图 6-2 所示。
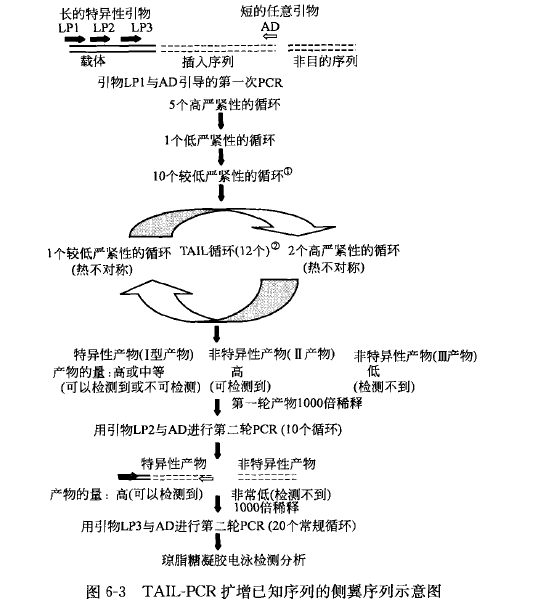
TAIL-PCR 的基本原理是利用一系列序列特异性的巢式引物和一个短的任意引物引导扩增已知序列的侧翼序列,它是一种半特异性的 PCR 反应,由于两类引物的退火温度不同从而可以通过控制反应过程中的退火温度有效的控制特异性和非特异性产物的扩增。在 TAIL-PCR 中序列特异性的巢式引物较长、退火温度较高,因此在 PCR 反应中退火温度的高低(相对)对它与目的序列的退火没有太大的影响,在高、低两种退火温度下都可以与已知序列发生特异性的退火,而序列短的任意引物则仅可以在退火温度较低时与未知序列(已知序列的侧翼序列)发生退火,通过高低退火温度的交替进行,使目的基因得到有效的扩增。TAIL-PCR 具体过程如图 6-3 所示。

来源:丁香实验团队
操作方法
热不对称 PCR 是传统的引物浓度不对称 PCR 的发展,它利用一对引物的碱基数目与组成不同,造成退火温度的差异而实现。
交错式热不对称 PCR热不对称 PCR 的发展和应用使的不对称 PCR 方法变得更加简单和实用,而 Yao-Guang Liu 等后来又将其进一步发展产生了 TAIL-PCR(thermal asymmetric interlaced PCR):交错式热不对称 PCRIS。TAIL-PCR 的目的是为了扩增与已知序列相邻的未知序列,相对于实现同样目标的其它方法 TAIL-PCR 具有非常明显的优点。
相关产品推荐