简介
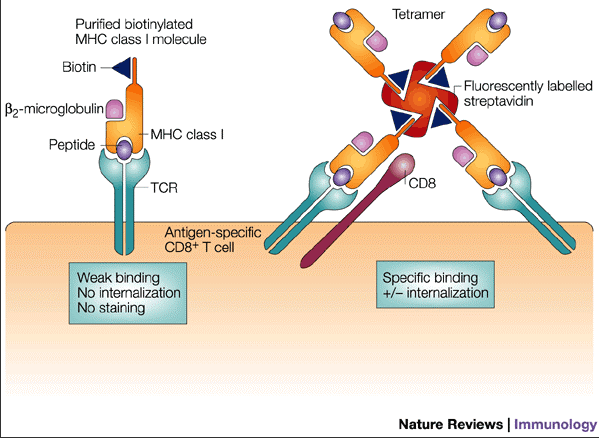
T 细胞通过 T 细胞抗原识别受体识别特定抗原分子(表位),机体的 T 细胞池虽然可以针对多种抗原表位产生应答,但针对一个特定的抗原表位只有特异性 T 细胞才能产生应答。与抗原提呈细胞上的 MHC-抗原肽复合体结合刺激 T 细胞后,T 细胞可以发生增殖反应并产生细胞因子。四聚体结合技术和酶联免疫斑点技术(ELISPOT)已被用于检测 T 细胞池中能与特定抗原肽结合或对特定抗原肽刺激分泌细胞因子的 T 细胞比例。
原理
利用细胞示踪染料检测抗原特异性 T 细胞前体增殖的频数的原理是用流式细胞术与四聚体技术和细胞因子染色技术相结合,利用示踪染料检测针对抗原刺激时不同 T 细胞组分的增殖反应,用于检测针对特定抗原刺激时 T 细胞池中能结合四聚体、分泌细胞因子并且发生增殖的 T 细胞前体细胞频数。
材料与仪器
器材:
① 12、24、96 孔细胞培养板;
② 15 或 50 ml 圆锥底离心管;
③ 离心机;
④ 彩色荧光微球(RCP-30-5,Spherotech,Libertyville,IL);
⑤ 流式细胞仪。
试剂:
① 合适的淋巴细胞培养基(例如适合人类细胞的 AIMV 培养基(GibcoTM Invitrogen Corporation,Carlsbad,CA)和血清);
② 用于刺激的抗原蛋白或肽段;
③ 作为增殖反应阳性对照刺激物的刀豆蛋白 A 或者植物血凝素(PHA,Sigma,St. Louis,MO);
④ 示踪染料:PKH26 或 PKH67[Cell Census Plus or Cell Linker 试剂盒(Sigma)],或者二乙碱琥珀酰亚胺酯(CFSE)(Molecular Probes,Eugene,OR);
⑤ 胎牛血清(Sigma 或其他公司)或人 AB 血清(Nabi,Boca Raton,FL);
⑥ Brefeldin A(Sigma);
⑦ 佛波醇肉豆蔻酸(PMA)和离子霉素(Ionomycin)(Sigma);
⑧ 洗涤缓冲液:含 1% 牛血清白蛋白和 0.1% 叠氮钠的 PBS;
⑨ 人球蛋白 Cohn 组分 Ⅱ 和 Ⅲ(Sigma)。
步骤
利用细胞示踪染料检测抗原特异性 T 细胞前体增殖的频数的基本过程可分为如下几步:
1、培养细胞的示踪染料染色
利用 Ficoll-Hypaque 密度梯度离心从人外周血制备含单核细胞的淋巴细胞(PBMC)。细胞准备过程均需要在无菌条件下进行,最终培养时 PBMC 细胞浓度为 3 × 106/孔,由于用示踪染料标记和洗涤的过程中有细胞丢失,因此推荐起始细胞数目为(5~6)× 106。当 PBMC 分离后,培养前,用细胞示踪染料(PKH 或 CFSE)进行染色,由于 PKH26(吸收光谱 551 nm/发射光谱 567 nm)或者 PKH67(吸收光谱 490 nm/发射光谱 504 nm)与其他荧光染料的光谱具有较好的兼容性而被选为示踪染料。在培养的末期,细胞可以进行表型、四聚体和胞内细胞因子染色。如果要进行细胞内细胞因子染色,必须用抗原再刺激 16 h 以上。
1.1 PKH 染色过程
1.1.1 将细胞用不含血清的培养基洗涤 2 次,并且用血球计数器进行计数,在第 2 次洗涤时吸弃上清,保留 25~50 μl 不含血清的培养基和细胞沉淀,并且轻轻重悬细胞。
1.1.2 在另一个干净圆锥底试管中用 Sigma 的 Cell Census Plus 试剂盒中的稀释液 C 将 PKH 贮存液稀释至终浓度的 2 倍(如果最终浓度为 4 μM,则稀释为 8 μM),稀释后的染料应立即使用,未用完的染料将被丢弃。染料的浓度应该事先预试,既要保证有足够的荧光强度及染色后细胞的活力,又要保证高强度的荧光不会给其他荧光素的光谱补偿带来困难,对人淋巴细胞而言,染料的终浓度大约为 4 μM。
1.1.3 用稀释液 C 将细胞浓度调整为 2 × 107 细胞/ml,使用的圆锥底离心管的体积应该是细胞悬液体积的 6 倍以上,这种稀释液是专为均匀分布这种亲脂性染料而设计,但对细胞具有一定的损害,因此细胞保持在这种稀释液中的时间应该尽可能短。
1.1.4 在细胞悬液中加入等体积的 2 × PKH 染料,室温作用 3 min。由于染料标记到细胞是非常迅速的(通常 80% 是在 15 s 内完成),为了保证染料标记的均一性,细胞和染料轻轻混匀并快速地结合非常重要。
1.1.5 3 min 后,细胞悬液中加入等体积的人 AB 血清或胎牛血清(FBS)终止染料的结合。
1.1.6 用培养基洗涤 3 次,计数,重新调整细胞浓度至 1.5 × 106 细胞/ml。
1.2 CFSE 染色过程
1.2.1 在细胞标记前,用 PBS 将 10 mM CFSE 的贮存液稀释为 1 mM。
1.2.2 用不含血清的培养基将细胞洗涤 2 次,并且用血球计数器进行计数,并将细胞浓度调整至 5 × 107 个细胞/ml,用的圆锥底离心管的体积应该是细胞悬液体积的 6 倍以上。
1.2.3 在每毫升细胞悬液中加入 2 μl CFSE(CFSE 的终浓度为 2 μM),染料的浓度必须事先预试并调节到既有足够的荧光强度又能保持染色后细胞的活力(如果染料的荧光强度过高,将会给其他荧光素的光谱补偿带来困难)。
1.2.4 细胞与染料在 37 ℃ 共同孵育 15 min,并不时地混匀。
1.2.5 15 min 后,用 5 倍体积预冷的含 10% FBS 的培养基终止染色。
1.2.6 室温静置 5~10 min。
1.2.7 用培养基洗涤 3 次,并且重新调整细胞浓度为 1.5 × 106 细胞/ml。
1.3 细胞培养
1.3.1 示踪染料标记细胞后,用台盼蓝拒染法计数细胞并检查细胞活率。
1.3.2 将细胞加入 24 孔细胞培养板中(3 × 106 细胞/孔)或 12 孔细胞培养板(5 × 106 细胞/孔),细胞终浓度为 1.5 × 106 细胞/ml。
1.3.3 在开始培养时加入抗原肽段或蛋白,抗原的浓度应该确保能够促进细胞增殖,这个浓度应该事先通过 3H 掺入实验或其他染料稀释实验滴定。
1.3.4 作为细胞增殖阳性对照,在未加入抗原刺激的培养细胞中加入终浓度为 5 μg/ml ConA 或 2 μg/ml PHA,培养 4~5 d。
1.3.5 作为细胞增殖阴性对照,细胞培养孔中不包含丝裂原或抗原。
1.3.6 将细胞培养板置 37 ℃、5% CO2 条件下培养 6~10 d,时间长短取决于增殖反应的强度,定期检查培养细胞并在需要时加入新鲜培养基。
1.3.7 如果不进行表型、四聚体结合和胞内细胞因子染色,将培养结束的细胞离心,并用 0.2~0.4 ml 洗涤缓冲液重新悬起,直接通过流式细胞术进行分析。相应的,也可以在细胞洗涤后加入 0.2~0.4 ml 含 1% 甲醛的洗涤缓冲液,4 ℃ 过夜固定后,通过流式细胞术进行分析。
2、培养最后一天,维持细胞内细胞因子可选的处理方法
如果要进行细胞内细胞因子染色,必须在培养的最后 1d 再次加入抗原刺激,并用 Brefel-din A 处理,确保细胞合成新的细胞因子并储备于胞质中以便于检测。
2.1 细胞培养结束前 16 h,加入抗原再次刺激细胞(对照不需要加入)。
2.2 同时,孔中加入终浓度为 1 μg/ml 的 Brefeldin A。
2.3 分泌细胞因子的阳性对照孔,加入终浓度为 10 ng/ml 的 PMA 和 500 ng/ml 的 Ionomy-cin。
3、细胞培养结束后,流式细胞术分析前的细胞可选染色
细胞培养结束后,细胞可进行四聚体结合和(或)表型染色分析,如果需要,细胞可经固定、通透和细胞内细胞因子染色。
1 表型分析和(或)四聚体结合染色
1.1 培养结束后,收集细胞并离心。
1.2 用洗涤缓冲液(如果要进行细胞内细胞因子染色,加入终浓度为 1 μg/ml 的 Brefeldin
A)重新悬起细胞,细胞浓度调整为(3~8)× 103 细胞/0.03 ml。
1.3 加入等体积的人球蛋白(Cohn 组分 Ⅱ 和 Ⅲ 储存液为 6 mg/ml)混合,封闭非特异性 Fc 受体的结合。
1.4 将细胞 [(3~8)x105 细胞,0.06 ml] 加入 96 孔板中,加入 2~10 μl 饱和浓度的四聚体,37 ℃ 作用 20 min。
1.5 加入 5~20 μl 饱和浓度的表型抗体,4 ℃ 作用 20 min。
1.6 如果不做细胞因子染色,用预冷的洗涤缓冲液洗涤 3 次(200 μl/孔),用含 1% 甲醛的洗涤缓冲液(0.2 ml/孔)4 ℃ 固定过夜,第 2 天进行流式细胞分析。
2 细胞内细胞因子染色
2.1 如果进行细胞内细胞因子染色,用含 Brefeldin A 洗涤缓冲液洗涤 3 次(200 μl/孔),然后用含 4% 甲醛的洗涤缓冲液室温固定 20 min。
2.2 固定结束后,含 0.1% 皂素(用于穿膜)的洗涤缓冲液洗涤 3 次。
2.3 加入 0.1 ml 含 0.1% 皂素的洗涤缓冲液重新悬起细胞,加 10 μl 人球蛋白 Cohn 组分 (6 mg/ml)。
2.4 每孔加入 5~20 μl 饱和浓度的抗细胞因子荧光素标记抗体或相应的同型对照,细胞培养板 4 ℃ 孵育 60 min。
2.5 用含 0.1% 皂素的洗涤缓冲液洗涤 2 次,再用单纯的洗涤缓冲液洗涤 1 次。
2.6 将细胞用 0.2~0.4 ml 含 1% 甲醛的洗涤缓冲液重新悬起,4 ℃ 过夜,第 2 天进行流式细胞分析。
4、流式细胞术
4.1 流式细胞仪的激光激发和光电倍增管(PMT)的带通滤光片需要与选择的荧光染料相匹配,PKH67 和 CFSE 的激发和发射光谱的特性与绿色荧光素相似,PKF26 则与藻红蛋白(PE)相似,3 种染料都能被 488 nm 的激光器激发。
4.2 包括示踪染料在内的荧光参数均需要对数放大,检测四聚体结合、表型分析细胞因子染色的 PMT 电压参数需要设置使得阴性细胞处在 4 个十进制刻度的第一个刻度以下,检测示踪染料的 PMT 电压参数需要设置使得未增殖细胞处在最高一个十进制刻度(当相对荧光强度的刻度范围在 1~10 000 时,适宜的位置大约在 5000)。
4.3 前向散射和侧向散射通常按照线性放大采集数据,散射参数的电压/放大应该设置使得利于设门,即排除具有较低前向散射光的死细胞和碎片,但能包含具有较高前向和侧向散射光的增殖细胞。
4.4 当进行多参数分析时,光谱补偿调节尤为重要,但当 PKH 和 CFSF 荧光强度过亮,补偿调节将很困难,因此使用低浓度的示踪染料将有利于补偿调节。
4.5 为了进行准确的数据分析,数据文件中必须采集足够多的细胞数据,从而使得频数最少的目的细胞在其中有足够多的细胞。例如,经设门圈出四聚体阳性细胞或 PKH/CFSE 较暗的细胞或细胞因子阳性细胞,采集足够多细胞数进入数据文件,使得上述门内不少于 500 个细胞。所有采集自细胞的数据以列表模式文件储存。
4.6 在相同的电压/放大的参数设置下,必须将不同荧光强度的彩色荧光球的数据采集入数据文件(前向和侧向散射的改变会影响荧光球在侧向散射的阈值之上)。
5、数据分析
在数据分析之前,根据细胞表型和(或)细胞因子以及四聚体对细胞进行设门。对于增殖和前体频数分析来说,用于增殖分析的 ModFit 软件可用于 PKH 和 CFSE 染料的分析。在 ModFit3.1 或更高版本的软件将能够计算前体频数。
来源:丁香实验