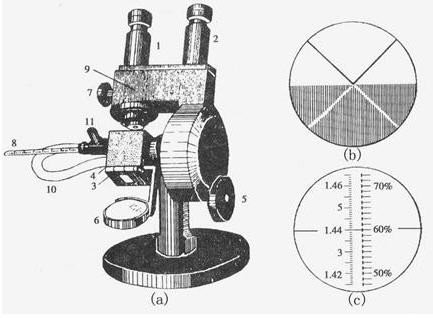
简介
掌握植物在逆境或者其他损伤的情况下,细胞受伤害原理以及测量方法;掌握电导率的测定方法;学会运用统计学方法,对不同植物在冷害后其细胞损伤程度进行比较和分析。
原理
小分子或生物大分子的电解质水溶液都可导电,电解质溶液导电服从欧姆定律。 如在溶液中两电极加上外电压V,通过的电流为A,则两极间电阻为R ,即:
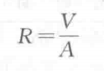
溶液的电阻大,导电能力就小,将溶液电阻的倒数定义为溶液的电导,代号为(单 位S),即:
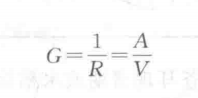
测定电解质溶液的电导,取面积为1 cm2的两片电极,相距1 cm,中间1 cm3溶液所表现 的电导称为该溶液的电导率,也称比电导,
k = GQ
K单位是S・cm-1通常用 μS · cm-1,式中Q表示电极常数可用实验方法测定。
植物细胞膜对维持细胞的微环境和正常的代谢起着重要的作用,在正常情况下,细胞膜对物质具有选择透过能力。当植物受到逆境(如高温、低温、干旱、盐渍或病原菌侵染)影响 时,细胞膜遭到破坏,使膜的功能受损或结构破坏,通透性增大,从而使细胞内的物质(尤其是电解质)大量外渗,从而引起组织浸泡液的电导率发生变化。伤害愈重,外渗愈多,电导度的增加也愈大。故可用电导仪测定外液的电导度增加值而得知伤害程度。
材料与仪器
步骤
植物组织逆境伤害程度的测定的基本过程可分为如下几步:
1. 容器的洗涤:电导法对水和容器的洁净度要求严格,水的电导值为1~20 μS;所用容器 必须彻底清洗,再用去离子水冲净,倒置于洗净而垫有洁净滤纸的搪瓷盘中备用。为了检查 试管是否洁净,可向试管中加入电导值在1~20 μS的新制去离子水,用电导仪测定是否仍维 持原电导数据。
2. 试验材料的处理:分别在正常生长和逆境胁迫的植株上取同一叶位的功能叶若干片。 若没有逆境胁迫的植株,可取正常生长的植株叶片若干片,分成2份,用纱布擦净表面灰尘。 将其中1份放在-20 °C左右的温度下冷冻20 min(或置于40 °C左右的恒温箱中处理30 min) 进行逆境胁迫处理。另1份裹入潮湿的纱布中放置在室温下作对照。
3. 测定:
(1)将处理组叶片与对照组叶片用去离子水冲洗2次,再用洁净滤纸吸净表面水分。用 6~8 mm的打孔器避开主脉打取叶圆片(或切割成大小一致的叶块),每组叶片打取叶圆片30片,分装在3支洁净的刻度试管中,每管放10片。
(2)在装有叶片的各管中加入10 mL的去离子水,并将大于试管口径的塑料纱网放入试 管距离液面1 cm处,以防止叶圆片在抽气时翻岀试管。然后将试管放入真空干燥箱中用真 空泵抽气10 min(也可直接将叶圆片放入注射器内,吸取10 mL的去离子水,堵住注射器口 进行抽气)以抽出细胞间隙的空气,当缓缓放入空气时,水即渗入细胞间隙,叶片变成半透明 状,沉入水下。
(3)将以上试管置于室温下保持1 h,其间要多次摇动试管,或者将试管放在振荡器上振 荡1 h。1 h后将各试管充分摇匀,用电导仪测其初电导值(Gi)。
(4)测定完毕,将各试管盖塞封口,置沸水浴中10 min,以杀死植物组织。取出试管后用 自来水冷却至室温,并在室温下平衡10 min,摇匀,测其终电导值(G2)。
(5)另用一试管10 mL的去离子水(或蒸馋水)作空白,测定空白电导值(即本底值)。
4. 计算按式(35-1)计算相对电导度:

相对电导度的大小表示细胞膜受伤害的程度。
由于对照(在室温下)也有少量电解质外渗,故可按式(35-2)计算由于低温或高温胁迫而 产生的外渗,称为伤害度(或伤害性外渗)。

式中:Lt一处理叶片的相对电导度;
Lck一对照叶片的相对电导度。
按式(32-3)计算相对电导度:

注意事项
1. CO2在水中的溶解度较高,测定电导时要防止高CO2气源和口中呼出的CO2进入试 管,以免影响结果的准确性。
2. 温度对溶液的电导影响很大,故G1和G2必须在相同温度下测定。
3. 在电导度测定中一般应用去离子水,若制备困难可用普通蒸馏水代替,但需要设一空 白试管,蒸馏水作空白,测定样品时同时测定空白电导值(即本底值)。
来源:丁香实验