简介
掌握利用赤霉素(GA3)诱导合成的 a- 淀粉酶降解淀粉,使淀粉遇碘呈蓝紫色的颜色反应减弱来测定淀粉酶活性的方法。加深对赤霉素诱导 a- 淀粉酶合成的生理特性的认识。
原理
种子萌发时,胚乳内储藏的淀粉发生水解作用,产生还原糖。目前已经清楚,赤霉素是诱导大麦糊粉层细胞内 a- 淀粉酶合成的化学信使,当种子吸胀后,首先由胚分泌赤霉素,并释放到胚乳的糊粉层细胞中,诱导 a- 淀粉酶的合成。新合成的 a- 淀粉酶进入胚乳,可催化胚乳中储存的淀粉水解形成短链糊精和少量麦芽糖及葡萄糖为种子的萌发和幼苗的生长提供能量物质。
外加的GA3能代替胚所分泌的赤霉素的作用,诱导胚乳糊粉层细胞a-淀粉酶的合成在一定的浓度范围内,加入GA-的量与合成的 a- 淀粉酶活性成正比。根据淀粉遇碘呈蓝紫色的反应特性,可以检验淀粉酶活性。本实验利用GA3诱导种子合成的 a- 淀粉酶,降解淀粉使蓝紫色消失的反应,来判断GA3对 a- 淀粉酶的影响。
材料与仪器
步骤
(一)制作标准曲线
1. 以淀粉磷酸盐溶液(含淀粉1000 · L-1)为母液,用蒸馅水将其稀释成0 μg · L-1
10 μg · L -1、50 μg · L -1、100 μg · L -1、150 μg · L -1、 200 μg · L-1、250 μg · L-1、300 μg · L-1的淀粉磷酸盐溶液。
2. 取9支试管分别加入上述不同浓度的淀粉磷酸盐溶液各2 mL。然后加I2-KI溶液 2 mL和蒸儲水5 mL,充分摇匀。
3. 在580 nm波长处比色.以0浓度作空白校正仪器零点,准确读出各浓度的吸光度值。
4. 以淀粉的不同浓度为横坐标,以吸光度值为纵坐标,绘制标准曲线。
(二) 材料培养
1. 选取大小一致的大麦种子50粒,用刀片将每粒种子横切成两半,使之成无胚和有胚各半粒。
2. 将无胚和有胚的半粒种子分别置于新配制的1% 次氯酸钠溶液中消毒15 min,取出用 无菌水冲洗数次,备用。
(三) 淀粉酶的诱导
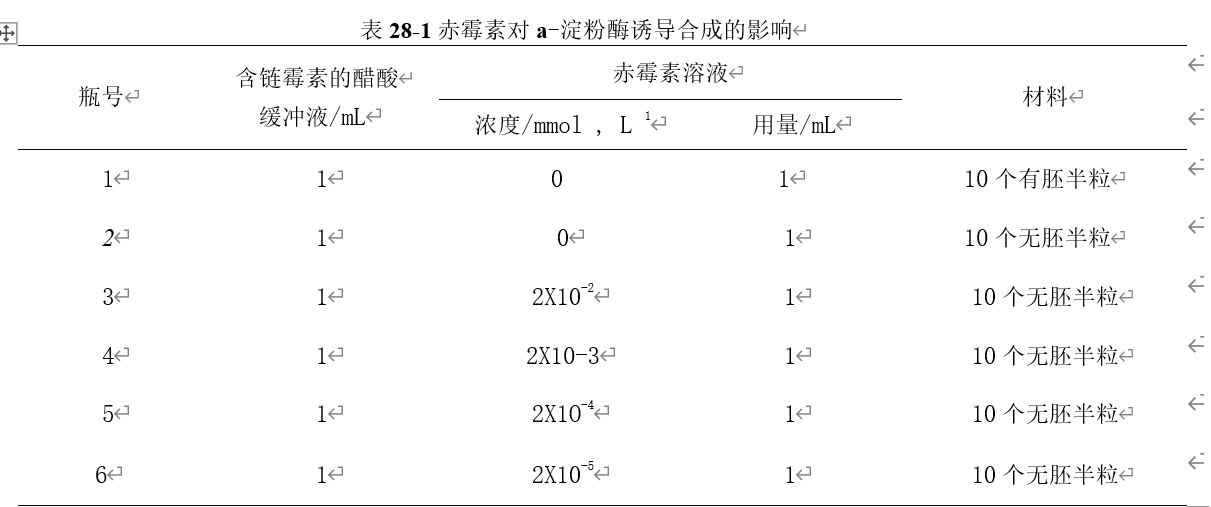
1. 取6个青霉素小瓶,编号。
2. 按表28-1加入各种溶液及材料。
3. 将上述小瓶于25 °C下培养24 h(最好进行振荡培养,如无条件,则必须经常摇动小瓶)。
(四) 淀粉酶活性测定
1. 从上述每个小瓶中吸取培养液0.2 mL,分别加入事先盛有8 mL淀粉磷酸盐溶液 (含淀粉1 000μg・L-1)的试管中,摇匀,在30 °C恒温箱中保温10 mino
2. 每一试管中加L2-KI溶液2 mL和蒸儲水5 mL,并充分摇匀。
3. 在580 nm波长下进行比色,测定其吸光度,调整仪器零点的溶液应与标准曲线相同。 准确读出各溶液的吸光度值,然后由标准曲线查得各溶液中淀粉的含量。
4. 以单位体积酶液单位时间内所分解的淀粉量来表示淀粉酶活性(mg · mL-1 · min-1)。
(五) 实验结果
以赤霉素浓度的对数为横坐标,a- 淀粉酶活性为纵坐标作图,分析赤霉素浓度与 a- 淀粉酶活性之间的关系。
注意事项
横切种子时,一定要使无胚的一半完全无胚,以免因胚的存在使结果出现偏差。
来源:丁香实验