简介
显微受精技术又称显微操作辅助受精技术,是20世纪80年代发展起来的一种体外受精技术。该技术通过显微操作仪修饰卵子透明带,或将精子或精细胞直接注入卵子内部,辅助其完成与卵子的受精过程。
目前有透明带修饰和精子注入两种方式,前者包括透明带钻孔法(zona drilling,ZD)和透明带切口法(partial zona dissection,PZD),后者包括透明带下注射法(subzonal insemination,SUZI)和胞质内注射法(ICSI)。
用途
材料与仪器
步骤
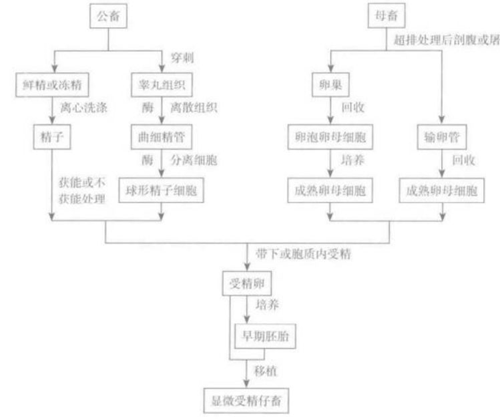
显微受精技术的基本过程可分为如下几步:
1.固定针和注射针的准备
(1)注射针制备:将经过消毒的外径为1 mm的毛细玻璃管固定在拉针仪上,调节好拉针仪的参数,拉出所需的理想针形。通常从针的一端到开始变细处的长度以8-10 mm为宜。
将拉制好的针管固定在煅烧仪上,在玻璃针内径5~6 μm处拉断玻璃针管。然后将针管以40°~50°的角度置于磨针仪上,在磨石上先加一些水,调节升降杆使针的尖端与磨石的平面刚好接触,把针磨成斜面。
将针置于煅烧仪上拔尖,拔尖时先将铂金球、玻璃针位置调整好,然后开始加热铂金球。这时将玻璃针慢慢靠近,当针尖稍微有些熔化时,迅速拉开,拉出的针尖应该是短而锐利的。将制备好的针置于用70% 乙醇清洗过的塑料盒中存放,用前经紫外线灯照射20分钟。
(2)固定针制备:将经过消毒的外径为1 mm的毛细玻璃管固定在拉针仪上,拉出理想的针形。将拉制好的玻璃管固定在煅针仪上,于外径方80~120 μm处拉断玻璃针管。
然后将断好的玻璃针管靠近铂金球,调整温度使电热丝发红,直至针口缩到30~40 μm时停止,针口须平滑,当内径变为20-40 μm时,停止加热。
2.卵子和精子的准备
(1)卵母细胞的收集和处理:卵母细胞来源主要有两种:一是经超数排卵获得的体内成熟的卵母细胞;二是从屠宰场收集卵巢,抽取未成熟的卵丘-卵母细胞复合体(COCs)经体外成熟(IVM)培养获得。
显微注射前,卵母细胞要用0.1% 的透明质酸酶处理,去除其周围的颗粒细胞,然后置于覆盖有液体石蜡的卵母细胞操作液中备用。对于脂肪含量较高的卵母细胞如牛和猪,可通过离心使卵母细胞中的脂肪滴被甩向一侧,使卵母细胞变得透明,以利于显微操作。
(2)精子的准备:新鲜或冻存的精子均可用于显微注射,使用前需要根据试验设计对精子进行若干处理,如:精子获能;去除精子尾部及顶体制备精核。
精子孵育液中加入PVP,一方面使游动的精子丧失运动能力,便于捕捉精子,另一方面经这样处理的精子不容易粘在注射针管壁上,利于精子的释放;精子孵育液中加入三硫苏糖醇(DTT),该物质对某些动物精核的解聚有一定作用,可以提高雄原核的形成率。
3.显微受精操作步骤
(1)显微操作时,如果是用有活力的精子做注射,则要破坏其尾部中段的质膜,使其失去活动能力,这个过程即称为精子制动。因为在正常受精过程中,精卵质膜融合,精子在卵母细胞质中释放一种能够激活卵母细胞的因子-精子因子(SF),引起卵母细胞胞质内的Ca浓度波动,从而激活卵母细胞。
制动的目的就是使精子注入卵胞质后能够较快地释放SF。精子制动后,将其从尾部吸入注射针。注射时,用固定针固定卵母细胞,使极体位于12点位置,注射针在3点位置穿过透明带,向9点方向深入卵胞质,先回吸少量卵胞质,以确定质膜已被刺破,再将精子注入卵胞质内。
(2)使用Piezo操作时,首先在注射针的尾部装入3-4 mm水银,再将注射针装入注射装置中。将水银向针尖推进,并在水银和注射针内的液体石蜡之间保留一段空气柱。
把注射针降到第1个PVP液滴中,来回吐吸操作液数次以润滑注射针管壁,并利用脉冲检查水银跳动情况,若看到水银跳动,说明Piezo电脉冲传递顺利。针装好后制作PVP液-液体石蜡-PVP液缓冲柱,并保持水银在注射视野范围内。
注射前,用卵吸管把8~10枚卵母细胞移入操作液滴中,然后注射针在精子液滴中吸取1个精子放入第3个PVP液滴中,用针尖在精子尾部迅速划过进行制动,随后从尾部吸取精子。
注射时调整极体在12点钟位置,从3点钟位置进针,同时用Piezo脉冲击穿透明带,继续进针后将精子推至针尖处,此时质膜因弹性随注射针尖凹入卵内,至针尖接近对侧质膜时,用Piezo弱脉冲击穿质膜,吐出精子,并回吸注入卵内的多余液体,轻轻退针,完成一次注射。
4.注射卵的激活及体外培养
1.注射卵的激活 在传统的ICSI中,显微注射过程对卵母细胞的刺激就可以充分激活人、兔、鼠等的卵母细胞;但对牛和猪等,注射针和精子的机械刺激不足以激活卵母细胞,需要额外的化学或其他刺激才能激活注射卵,而卵母细胞激活是精子解聚和雄原核形成的前提。
来源:丁香实验







