简介
酵母双杂交系统(yeast two-hybrid)以酵母遗传分析为基础,研究反式作用因子之间相互作用对真核基因转录调控影响的实验系统。
其最有价值的应用是用 BD-X 筛选由 AD-Y 构成的 cDNA 文库,以获得新的蛋白质之间的相互作用,并分析研究新的基因。
本技术不仅可用于鉴定新的蛋白质相互作用,证实可疑的相互作用,确定相互作用的结构域,而且可直接获得编码相互作用的蛋白的基因。
原理
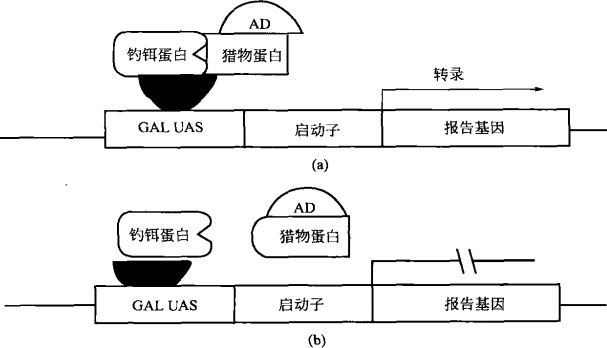
酵母双杂交的基本原理是:许多转录因子都包含两个相互独立的功能结构域,即 DNA 结合结构域(binding domain,BD)和转录活化结构域(activedomain,AD)。
转录因子通过 BD 和 AD 分别与 DNA 上的特异序列结合,从而启动相应基因的转录。
酵母双杂交系统首先构建两种反式作用因子,将蛋白质 X 与报告基因转录因子特异的 BD(如 Gal4-BD,LexA-BD)融合,成为钓饵(bait);蛋白质 Y 与特异的 AD(Gal4-AD,B42-AD)融合为猎物(prey)。
当编码两种结构域的基因在酵母细胞核内同时表达时,若蛋白 X 与 Y 之间存在非共价作用,就会使 AD 与 BD 两结构域的上游活化序列(upstream ac-tivation sequence,UAS)相互接近,进而激活转录过程,使报告基因(如 HIS3、LEU 和 lacZ 等)得到表达(如图所示)。
用途
酵母双杂交系统最有价值的应用是用 BD-X 筛选由 AD-Y 构成的 cDNA 文库,以获得新的蛋白质之间的相互作用,并分析研究新的基因。
本技术不仅可用于鉴定新的蛋白质相互作用,证实可疑的相互作用,确定相互作用的结构域,而且可直接获得编码相互作用的蛋白的基因。
材料与仪器
器材:
①电热恒温培养箱
②超净工作台
③台式高速离心机、高速冷冻离心机
④恒温水浴锅、恒温水浴摇床
⑤高压灭菌锅、除菌用滤器
⑥pH 计
⑦电转化仪、电转化杯
⑧旋涡混匀器
试剂:
①材料:酵母 AH109 或 Y187,E.coli TG1,cDNA 文库
②胰蛋白胨、酵母抽提物、琼脂、葡萄糖、各种氨基酸、酵母氮碱
③ NaCl、PEG4000
④吡喃半乳糖苷衍生物(5-bromo-4-chloro-3-indolyl-α-D-galactopyranoside,X-a-gal)或 X-β- gal
⑥鱼精 DNA
⑦ DMSO、甘油
⑧醋酸锂
⑨ SDS、Lyticase
步骤
酵母双杂交的基本过程可分为如下几步:
1.酵母感受态细胞的制备和载体的转化(小规模转化)
(1)从 YPD 平板上挑取生长 1~2 周、直径 2~3 mm大小的新鲜酵母 AH109 单克隆,接种到 1 ml 的灭菌去离子水中,剧烈振荡以分散酵母团。
(2)转移上述酵母细胞到 30 ml YPD 培养液中。
(3)30 ℃、250 r/min 振摇培养过夜,直到稳定期(OD600>1.5)。
(4)取适量上述培养物转入150 ml YPD 培养液中至 OD6oo 达到 0.2~0.3。30 ℃、250 r/min振摇培养至 OD600 达到 0.5±0.1。
(5)转入 50 ml 离心管中,室温 4000 g 离心 5 min,弃上清液。在25~50 ml 灭菌TE或蒸馏水中剧烈振荡重悬细胞。重复离心弃上清。
(6)在 0.75 ml 1xTE/LiAc 中重悬沉淀,此即为酵母感受态细胞,冰浴备用。
(7)在 1.5 ml Eppendorf 管中加入下列成分并振荡混匀。
(8)加入酵母感受态细胞 0.1 ml,振荡混匀。
(9)加入 0.6 ml 灭菌的 PEG/LiAc 溶液并高速振荡混匀。
(10)30 ℃、200 r/min 振摇培养 30 min。
(11)加入 70 μlDMSO,上下轻轻颠倒混匀(不能剧烈振荡)。42 ℃热休克 15 min,立即冰浴冷却 2 min。
(12)4000 g 离心 5 min,尽可能弃尽上清液。在0.5 ml 的 1xTE(pH7.5)中重悬细胞备用。
2.转化混合物的铺盘和筛选
(1)按图 12-5 所示的方法将上述转化混合物涂布于适当培养基平板上(直径 100 mm的培养皿)。一个新的钓饵与文库的结合,很难去预测最适的方法。
因而,各 铺1/3 的转化物于不同的选择培养基上:低严谨度(SD/-Leu/-Trp),中严谨度(SD/-His/-Leu/-Trp)和高严谨度(SD/-Ade/-His/-Leu/-Trp/X-a-gal)的培养基上。
(2)30 ℃ 倒置培养至长出克隆,其中在 X-a-gal 培养基上显蓝色的克隆为阳性。也可不加 X-a-gal,按步骤(3)进行 β 半乳糖苷酶滤膜印迹法筛选。
(3)β 半乳糖苷酶滤膜印迹实验确定阳性克隆
①准备 Z 缓冲液/X-β-gal 溶液。
②用镊子将一干燥的灭菌硝酸纤维滤膜(或滤纸)置于上述菌落盘上,轻轻用镊子压膜以便克隆黏附到滤膜上。
③当滤膜均匀地润湿后,小心地将滤膜从培养基上取出,放入液氮中。
④在完全浸入液氮中约 15 s 后,将滤膜取出并将有克隆的一面朝上放入洁净培养皿(或皿盖)中。
⑤加 1~2 mlZ 缓冲液/X-β-gal 溶液,至滤膜全部润湿。
⑥30 ℃ 静置孵育。在8h内检查蓝色克隆的出现。
3.阳性克隆的鉴定和证实
(1)将半乳糖苷酶阳性的克隆划线接种于 SD/-Leu/-Trp/X-α-Gal 盘上;或者接种于 SD/-Leu/-Trp 盘上,长出克隆后再进行β半乳糖苷酶滤膜印迹法鉴定。同时储存阳性克隆于 -70 ℃。
(2)30 ℃ 倒置培养 4~6 d。观察克隆颜色的变化或用 β 半乳糖苷酶滤膜印迹测定来显示颜色的变化。
(3)重复上述步骤(1)~(2)2~3次。
4.酵母质粒的分离
(1)在阳性克隆酵母盘上扩增一定数量的酵母,刮下约 30 μl,加 50 μlTE(pH7.0),旋涡振荡以悬浮细胞。
(2)加 10 μl Lyticase 裂解液(5 U/μl),旋涡振荡或吸管反复吹打混匀。
(3)37 ℃、250 r/min振摇孵育 1 h。
(4)加 10 μl 20% SDS,旋涡振荡 1 min。
(5)冷冻(-20 ℃)/融化一次,旋涡振荡以充分裂解细胞。
(6)用 TE 补足 200 μl。
(7)加 200 μl 酚-氯仿(1:1),高速旋涡振荡 5 min。
(8)10000 g 离心 10 min,转移水相于新的 Eppendorf 管。
(9)加 1/10 体积的 5 mol/L NH4Ac 溶液和两倍体积的无水乙醇。
(10)-70 ℃ 冷冻 1 h。
(11)10000 g 离心 10 min,弃上清液。
(12)干燥 DNA 沉淀,溶解于 20 μl 灭菌水中。
5.酵母质粒的电转化
(1)将2~5 μl 酵母质粒加入 40 μl 感受态酵母细胞中,混匀,冰浴。
(2)混合液转入冰预冷的电转化杯中,设置适当的参数(如 1.8 kV,25 μF,200 Ω),电击。
(3)迅速将细胞液转入 1 ml SOC 培养液中,轻轻混匀。37 ℃、250 r/min 振摇孵育 1h。
(4)4000 g 离心 5 min,弃上清液,保留 100 μl 左右培养液,轻轻重悬后涂布于 LB/Amp 培养皿平板,37 ℃ 倒置培养过夜。
细菌质粒按常规方法抽提。将抽取的质粒进行小规模转化实验以证实阳性克隆与已知基因的相互作用。
用插入 cDNA 片段两端的限制性核酸内切酶酶切质粒,琼脂糖凝胶电泳鉴定插入片段的大小,并以此进行分类。
7.代表性克隆与钓饵的共转化
取每类中的代表性克隆与钓饵共转化以证实在酵母中是否确实相互作用(方法同小规模转化实验)。
8.对证实的阳性克隆质粒进行测序。
9.测得的序列进行 Blast 比较。如为未知的 cDNA 序列,可进一步进行其他的生物信息学分析(www.ncbi.nlm.nih.gov/blast)。
注意事项
(1)小规模转化实验常用于:证实不能自我活化报告基因的 DNA-BD/钓饵,确证 DNA-BD/钓饵对宿主是否具有毒性,对照实验以及顺序性转化时用于转化 DNA-BD/钓饵。
顺序转化即 DNA-BD/钓饵质粒先通过小规模转化进入酵母,然后再将AD 融合的库质粒转人选择的酵母克隆中。
(2)一般抽提的酵母质粒由于 DNA 含量少而且混有杂质,用化学转化方法很难获得转化的细菌克隆,故适合用电转化法。
电转化时,应尝试不同的设置以找到合适的参数。
(3)在 β 半乳糖苷酶滤膜印迹实验中,克隆应有 1~3 mm 直径大小。如果每盘上克隆只有几个,可将克隆集中到一主盘上来测定。
为了方便确定阳性克隆,可用尖头镊子在滤膜和培养基上扎几个小洞(不对称分布)做位置标记。
来源:丁香实验