材料与仪器
步骤
3.1 植物材料
( 1 ) 洋葱鳞茎,除去棕色干枯的外皮,用自来水清洗,将每一个正立放在加有大约 90 ml 过滤水的圆桶状玻璃容器中,这样只有底部浸没在水中(见注释 3)。水必须以 10~20 ml/min 的速率充气。每隔 24 h 换一次水(见注释 4) 。
( 2 ) 开始培养的 2~3 天之后,大部分的鳞茎会长出很多根;培养 3 天之后,可用于 95% 的鱗每个茎上长出多于 40 条的根,每条至少 2 cm。这些根可用于收集。
( 3 ) 用解剖刀或刀片,去除掉根冠,然后用镊子夹取根尖前 3 mm;这部分就是根的分生组织(见注释 5 和注释 6) 。取大约 500 mg 的分生组织。
( 4 ) 将样品放入有盖培养皿中,培养皿直径 4 cm,装有 6 ml 提取介质,蛋白酶抑制剂 PMSF 需要在使用前加入。
( 5 ) 收集总量为 1 g 的根分生组织。
( 6 ) 培养皿必须被放置在冰块上。
( 7 ) 注意:必须在通风橱中进行实验。
( 8 ) 使用真空泵除去样品液的气体 10 min,以促进介质渗透入样品。
3.2 细胞核的提纯
( 1 ) 根的分生组织放在提取介质(可以在 4°C 条件下放置 15 min 到一夜),并分别用直径 100 μm,50 μm 和 30 μm 的网眼过滤。
( 2 ) 用抹刀收集留在尼龙布上的残留样品放入提取介质中,并将过滤的过程重复两次。在匀浆过程中使用搅拌器旋转棒搅拌试管中样品,速度为 16000 r/min,搅拌 3 次,每次 5s,两次之间停顿 5s。
( 3 ) 收集均一滤出液,并用在 800 g,4°C 离心 10 min 的方法漂洗滤出物。
( 4 ) 使沉淀在 1 ml 的提取介质中再次溶解。枪头抽吸助溶,并离心 2 次以上。在这个过程结束后,沉淀含有较纯的细胞核。
( 5 ) 将沉淀转移进含有 1 ml NSB 的 1.5 ml 离心管中。在光学显微镜下鉴定细胞核馏分,并检测它的丰度和纯度。可用相差显微镜检测,但是用简单的染色剂,如甲基绿/派洛宁,甲苯胺蓝,4, 6- 二脒-2- 苯基吲哚(DAPI ) 能够帮助鉴别细胞核(见注释 8 和注释 9)。
3.3 用细胞核分馏法提取蛋白质
我们用 Penman 和其合作者 [ 10] 描述的方法设计这套实验,并做相应改动 [14,15 ] 。最重要的改动是引入了提取大部分可溶性蛋白质的步骤。据报道可以溶解在低离子强度缓冲液中的细胞核蛋白质有一定的功能,因为其中富含在细胞核 RNA 代谢中活性较高的核糖核蛋白 [8,9,16,17 ] 。
总的来说,此方法包含一系列用溶解度为标准的蛋白质分馏方法。样液依次增加严谨性和离子强度。提取方法步骤如下所述。
1. 膜和残留细胞骨架的馏分
( 1 ) 第一步是被提纯的细胞核在 NSB 中反应,缓冲液中富含去垢剂。
( 2 ) 在细胞核样液中加入 ( V/V ) NP-40 和 0.5% ( V/V) 脱氧胆酸钠,并在 4°C 条件下在振荡器中振荡 10 min。然后在涡旋振荡器中振荡试管 2 次 ,每次 20s。
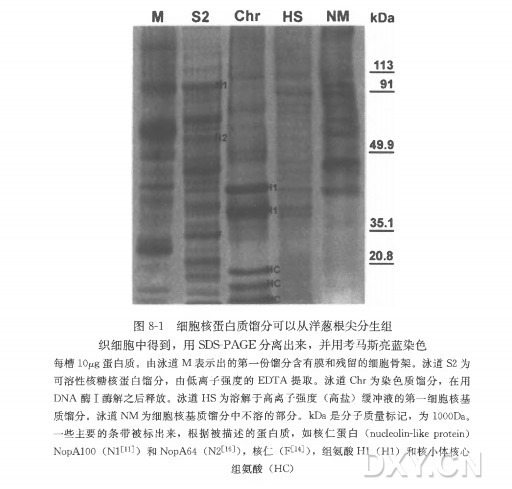
( 3 ) 在 1000 g、4°C 离心样液 10 min,收集上清液,这即是第一份馏分(膜和残留的细胞骨架,图 8-1,泳道 M) 。
2. 可溶性馏分(S2)
在涡旋振荡器上用 1 ml 低离子强度的缓冲液将沉淀再次溶解。在振荡器中于 4°C 条件下振荡 1h,然 后 1000 g、10 min,4°C 条件下离心,上清液为第二份馏分,被称为 S2 提取物,含有核糖核蛋白(图 8-1,S2) 。
3. 染色质馏分
( 1 ) 用 400 μl 含有 100 μg/ml 无 RNA 酶的 DNA 酶 I 和 0.5% Triton X-100 NBS 将沉淀在涡旋振荡器中溶解。在室温下振荡 30 min,这会酶解 DNA。
( 2 ) 加入硫酸铵(400 μl ) 以提取被酶解的 DNA,并在室温下反应 5 min ( 见注释 10)。如先前的步骤一样,反应都是在旋转的定轨振荡器中完成。
( 3 ) 在 2000 g 离心 10 min,取上清液,馏分中含有和染色质有关的蛋白质( 图 8-1,Chr)。
在再测之前稀释蛋白质,并根据稀释的倍数算出最后的结果。
( 1 ) 洋葱鳞茎,除去棕色干枯的外皮,用自来水清洗,将每一个正立放在加有大约 90 ml 过滤水的圆桶状玻璃容器中,这样只有底部浸没在水中(见注释 3)。水必须以 10~20 ml/min 的速率充气。每隔 24 h 换一次水(见注释 4) 。
( 2 ) 开始培养的 2~3 天之后,大部分的鳞茎会长出很多根;培养 3 天之后,可用于 95% 的鱗每个茎上长出多于 40 条的根,每条至少 2 cm。这些根可用于收集。
( 3 ) 用解剖刀或刀片,去除掉根冠,然后用镊子夹取根尖前 3 mm;这部分就是根的分生组织(见注释 5 和注释 6) 。取大约 500 mg 的分生组织。
( 4 ) 将样品放入有盖培养皿中,培养皿直径 4 cm,装有 6 ml 提取介质,蛋白酶抑制剂 PMSF 需要在使用前加入。
( 5 ) 收集总量为 1 g 的根分生组织。
( 6 ) 培养皿必须被放置在冰块上。
( 7 ) 注意:必须在通风橱中进行实验。
( 8 ) 使用真空泵除去样品液的气体 10 min,以促进介质渗透入样品。
3.2 细胞核的提纯
( 1 ) 根的分生组织放在提取介质(可以在 4°C 条件下放置 15 min 到一夜),并分别用直径 100 μm,50 μm 和 30 μm 的网眼过滤。
( 2 ) 用抹刀收集留在尼龙布上的残留样品放入提取介质中,并将过滤的过程重复两次。在匀浆过程中使用搅拌器旋转棒搅拌试管中样品,速度为 16000 r/min,搅拌 3 次,每次 5s,两次之间停顿 5s。
( 3 ) 收集均一滤出液,并用在 800 g,4°C 离心 10 min 的方法漂洗滤出物。
( 4 ) 使沉淀在 1 ml 的提取介质中再次溶解。枪头抽吸助溶,并离心 2 次以上。在这个过程结束后,沉淀含有较纯的细胞核。
( 5 ) 将沉淀转移进含有 1 ml NSB 的 1.5 ml 离心管中。在光学显微镜下鉴定细胞核馏分,并检测它的丰度和纯度。可用相差显微镜检测,但是用简单的染色剂,如甲基绿/派洛宁,甲苯胺蓝,4, 6- 二脒-2- 苯基吲哚(DAPI ) 能够帮助鉴别细胞核(见注释 8 和注释 9)。
3.3 用细胞核分馏法提取蛋白质
我们用 Penman 和其合作者 [ 10] 描述的方法设计这套实验,并做相应改动 [14,15 ] 。最重要的改动是引入了提取大部分可溶性蛋白质的步骤。据报道可以溶解在低离子强度缓冲液中的细胞核蛋白质有一定的功能,因为其中富含在细胞核 RNA 代谢中活性较高的核糖核蛋白 [8,9,16,17 ] 。
总的来说,此方法包含一系列用溶解度为标准的蛋白质分馏方法。样液依次增加严谨性和离子强度。提取方法步骤如下所述。
1. 膜和残留细胞骨架的馏分
( 1 ) 第一步是被提纯的细胞核在 NSB 中反应,缓冲液中富含去垢剂。
( 2 ) 在细胞核样液中加入 ( V/V ) NP-40 和 0.5% ( V/V) 脱氧胆酸钠,并在 4°C 条件下在振荡器中振荡 10 min。然后在涡旋振荡器中振荡试管 2 次 ,每次 20s。
( 3 ) 在 1000 g、4°C 离心样液 10 min,收集上清液,这即是第一份馏分(膜和残留的细胞骨架,图 8-1,泳道 M) 。
2. 可溶性馏分(S2)
在涡旋振荡器上用 1 ml 低离子强度的缓冲液将沉淀再次溶解。在振荡器中于 4°C 条件下振荡 1h,然 后 1000 g、10 min,4°C 条件下离心,上清液为第二份馏分,被称为 S2 提取物,含有核糖核蛋白(图 8-1,S2) 。
3. 染色质馏分
( 1 ) 用 400 μl 含有 100 μg/ml 无 RNA 酶的 DNA 酶 I 和 0.5% Triton X-100 NBS 将沉淀在涡旋振荡器中溶解。在室温下振荡 30 min,这会酶解 DNA。
( 2 ) 加入硫酸铵(400 μl ) 以提取被酶解的 DNA,并在室温下反应 5 min ( 见注释 10)。如先前的步骤一样,反应都是在旋转的定轨振荡器中完成。
( 3 ) 在 2000 g 离心 10 min,取上清液,馏分中含有和染色质有关的蛋白质( 图 8-1,Chr)。
在再测之前稀释蛋白质,并根据稀释的倍数算出最后的结果。
来源:丁香实验