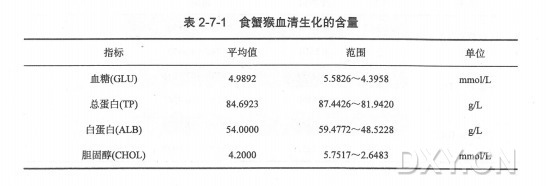
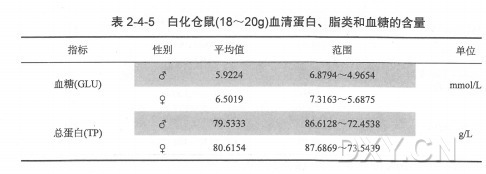
原理
血清蛋白质聚丙烯酰胺凝胶具有机械强度好、弹性大、透明、化学稳定性高、无电渗作用、设备简单、用样量少和分辨率高等优点,并可通过控制单体浓度或单体与交联剂的比例聚合成孔径大小不同的凝胶,用于蛋白质、核酸等物质的分离、定性和定量分析。
根据凝胶形状不同分为盘状电泳和板状电泳。盘状电泳是在直立的玻璃管中,利用不连续的缓冲液pH值进行电泳而命名,同时,样品混合物分开形成的带很窄,呈圆盘状,因此圆盘电泳这个名字成了不连续性和盘状的双关语。不连续盘状电泳具有很高分辨力,这是由于有三种效应存在、浓缩效应、电荷效应和分子筛效应。
1.浓缩效应:
管中装有三种不同的凝胶层,见附图,上层为样品胶,第二层为浓缩胶,这两层均为大孔胶、其缓冲为Tris-HCL缓冲液pH值为6.7。第三层为分离胶,该层为小孔胶Tris-HCL缓冲液,pH8.9。在上下电泳槽中充分以Tris-甘氨酸缓冲液,pH值为8.3。这样造成凝胶孔径、pH值、缓冲液的不连续性。在此条件下,HCL几乎全部电离为Cl-,甘氨酸有极少部分的分子解离成NH2CH2COO-,一般酸性蛋白质也能解离而带负电荷。当电泳系统通电后,这三种负离子同向正极移动。根据有效泳 动率的大小,最快的称为离子或先行离子(这里指Cl-),最慢的称为慢离子或随后离子(这里是NH2CH2COO-)。电泳开始后,快离子在前,在它之后形成一离子浓度低的区域,即低导区。电导与电压梯度成反比,所以低电导区就有了较高的电压梯度。这种高电压梯度使蛋白质和慢离子在快离子后面加速移动。在快离子和慢离子的移动速度相等的稳定状态建立后,则在快离子和慢离子之间造成一个不断向阳极移动的界面,由于蛋白质的有效泳动率恰好位于快、慢离子之间,因此蛋白质样品被夹在当中浓缩成一狭窄层,这种浓缩效应可使蛋白质浓缩数百倍。
2.电荷效应:
蛋白质样品在界面处被浓缩成一狭窄的高浓度蛋白区,但由于每种蛋白质分子所载有效电荷 不同,因而泳动率也不同,因此各种蛋白质样品按泳动率快慢顺序排列一个一个的圆盘区带。在进入分离胶时电荷效应仍起作用。
3.分子筛效应:
当被浓缩的蛋白样品从浓缩胶进入分离胶时,pH值和凝胶孔径突然改变,选择分离胶的pH值8.9(电泳时实际测量是9.5),使接近甘氨酸的pka(9.7~9.8),这样慢离子解离度增大,因而其泳动率也增加,此时慢离子泳动率超过所有蛋白质的有效泳动率,高电压梯度不复存在。此时各种蛋白质不仅由于其分子量或构型不同,在一个均一的电压梯度和pH条件下通过一定孔径的分离胶时所受摩擦力不同,受阻滞的程度不同,表现泳动率不同而被分开。
根据凝胶形状不同分为盘状电泳和板状电泳。盘状电泳是在直立的玻璃管中,利用不连续的缓冲液pH值进行电泳而命名,同时,样品混合物分开形成的带很窄,呈圆盘状,因此圆盘电泳这个名字成了不连续性和盘状的双关语。不连续盘状电泳具有很高分辨力,这是由于有三种效应存在、浓缩效应、电荷效应和分子筛效应。
1.浓缩效应:
管中装有三种不同的凝胶层,见附图,上层为样品胶,第二层为浓缩胶,这两层均为大孔胶、其缓冲为Tris-HCL缓冲液pH值为6.7。第三层为分离胶,该层为小孔胶Tris-HCL缓冲液,pH8.9。在上下电泳槽中充分以Tris-甘氨酸缓冲液,pH值为8.3。这样造成凝胶孔径、pH值、缓冲液的不连续性。在此条件下,HCL几乎全部电离为Cl-,甘氨酸有极少部分的分子解离成NH2CH2COO-,一般酸性蛋白质也能解离而带负电荷。当电泳系统通电后,这三种负离子同向正极移动。根据有效泳 动率的大小,最快的称为离子或先行离子(这里指Cl-),最慢的称为慢离子或随后离子(这里是NH2CH2COO-)。电泳开始后,快离子在前,在它之后形成一离子浓度低的区域,即低导区。电导与电压梯度成反比,所以低电导区就有了较高的电压梯度。这种高电压梯度使蛋白质和慢离子在快离子后面加速移动。在快离子和慢离子的移动速度相等的稳定状态建立后,则在快离子和慢离子之间造成一个不断向阳极移动的界面,由于蛋白质的有效泳动率恰好位于快、慢离子之间,因此蛋白质样品被夹在当中浓缩成一狭窄层,这种浓缩效应可使蛋白质浓缩数百倍。
2.电荷效应:
蛋白质样品在界面处被浓缩成一狭窄的高浓度蛋白区,但由于每种蛋白质分子所载有效电荷 不同,因而泳动率也不同,因此各种蛋白质样品按泳动率快慢顺序排列一个一个的圆盘区带。在进入分离胶时电荷效应仍起作用。
3.分子筛效应:
当被浓缩的蛋白样品从浓缩胶进入分离胶时,pH值和凝胶孔径突然改变,选择分离胶的pH值8.9(电泳时实际测量是9.5),使接近甘氨酸的pka(9.7~9.8),这样慢离子解离度增大,因而其泳动率也增加,此时慢离子泳动率超过所有蛋白质的有效泳动率,高电压梯度不复存在。此时各种蛋白质不仅由于其分子量或构型不同,在一个均一的电压梯度和pH条件下通过一定孔径的分离胶时所受摩擦力不同,受阻滞的程度不同,表现泳动率不同而被分开。
材料与仪器
步骤
一、试剂
1.分离胶缓冲液(pH8.9):取Tris36.3克加入1NHC148ml,再加水到100ml。
2.单体交联剂:取丙烯酰胺30g,N-N-亚甲基双丙烯酰胺0.8g,加蒸馏水到100ml。
3.浓缩胶缓冲液(pH6.7):取Tris5.98g加1NHC148ml,加蒸馏水到100ml。
4.加速剂:四甲基乙二胺。
5.催化剂:10%过硫酸铵,取AP1克加水到10ml。临用前现配。
6.电极缓冲液(pH8.3):称取Tris6g,甘氨酸28.9g溶解后加蒸馏水到100ml,用时稀释到1000ml。
7.0.5%氨基黑染色液:取考马斯兰R-250 0.5g,7%冰乙酸10ml,溶解后加水100ml,混匀。
8.7%乙酸:取含量37%的乙酸19ml加水至100ml。
9.20%蔗糖100μl与0.025%溴酚兰5μl组成样品稀释液。
二、凝胶柱的制备
1.取0.5×100cm的玻管,从另一端量取7cm、8cm两处,分别用玻璃铅笔划线,起端管口用小块玻璃纸包封好,插入橡皮垫,垂直立于试管架上。
2.取小烧杯2个,标号,先按表配制分离胶,待分离胶聚合后再配浓缩胶。
注意抽除溶液中气泡
3.取1号杯混匀溶液后,用滴管吸取加入上述玻璃管至刻度(离底端约7cm)再以玻璃管小心在胶液上覆以0.5cm厚度的水层,将此玻璃管垂直放在试管架上,约半小时以上,凝胶聚合完成后,用滤纸吸去覆盖的水层,这是分离胶。按表配制浓缩胶,摇匀,用滴管吸此液加于上述凝胶层,至第二刻度(8cm处)。同样覆盖0.5cm厚水层,垂直放于试管架上。聚合后,用滤纸吸去水层,这是浓缩胶。
三、加样
血清中加1/3体积50%甘油或20%蔗糖溶液,加入少量0.5%溴酚蓝作追踪剂,混匀,吸此样品30~50μ加在浓缩胶上。沿管壁加入电极缓冲液,直至项端。
四、电泳
1.将制备好的凝胶柱分别插入电泳槽底部的小孔,凝胶管垂直在上槽和下槽中,做好标记。加好上、下槽电极缓冲液(Tris-甘氨酸),插上电极,上负下正。
2.将电流调至3mA/管,电压100~200V,当溴酚蓝追踪剂接近管底时(约电泳30分至1小时),切断电源,将凝胶管取出(缓冲液倒入回收杯)。
五、剥胶
取下凝胶管,用带有10cm长针头注射器,内盛蒸馏水作润滑剂,将针头插入胶柱与管壁之间,边注水边旋转玻璃管,直至胶柱与管壁分开,用洗耳球轻轻在一端加压,使胶柱从玻璃管中慢慢滑出。
六、染色与脱色
从管中取出凝胶柱浸入0.5%~1%氨基黑染液中,一般染色约10~15分钟,但有的蛋白质需要更长时间。染色后用水冲去多余的染料,放入7%乙酸中脱色,直至余下黑色全部脱去为止。约30分钟。
1.分离胶缓冲液(pH8.9):取Tris36.3克加入1NHC148ml,再加水到100ml。
2.单体交联剂:取丙烯酰胺30g,N-N-亚甲基双丙烯酰胺0.8g,加蒸馏水到100ml。
3.浓缩胶缓冲液(pH6.7):取Tris5.98g加1NHC148ml,加蒸馏水到100ml。
4.加速剂:四甲基乙二胺。
5.催化剂:10%过硫酸铵,取AP1克加水到10ml。临用前现配。
6.电极缓冲液(pH8.3):称取Tris6g,甘氨酸28.9g溶解后加蒸馏水到100ml,用时稀释到1000ml。
7.0.5%氨基黑染色液:取考马斯兰R-250 0.5g,7%冰乙酸10ml,溶解后加水100ml,混匀。
8.7%乙酸:取含量37%的乙酸19ml加水至100ml。
9.20%蔗糖100μl与0.025%溴酚兰5μl组成样品稀释液。
二、凝胶柱的制备
1.取0.5×100cm的玻管,从另一端量取7cm、8cm两处,分别用玻璃铅笔划线,起端管口用小块玻璃纸包封好,插入橡皮垫,垂直立于试管架上。
2.取小烧杯2个,标号,先按表配制分离胶,待分离胶聚合后再配浓缩胶。
注意抽除溶液中气泡
3.取1号杯混匀溶液后,用滴管吸取加入上述玻璃管至刻度(离底端约7cm)再以玻璃管小心在胶液上覆以0.5cm厚度的水层,将此玻璃管垂直放在试管架上,约半小时以上,凝胶聚合完成后,用滤纸吸去覆盖的水层,这是分离胶。按表配制浓缩胶,摇匀,用滴管吸此液加于上述凝胶层,至第二刻度(8cm处)。同样覆盖0.5cm厚水层,垂直放于试管架上。聚合后,用滤纸吸去水层,这是浓缩胶。
三、加样
血清中加1/3体积50%甘油或20%蔗糖溶液,加入少量0.5%溴酚蓝作追踪剂,混匀,吸此样品30~50μ加在浓缩胶上。沿管壁加入电极缓冲液,直至项端。
四、电泳
1.将制备好的凝胶柱分别插入电泳槽底部的小孔,凝胶管垂直在上槽和下槽中,做好标记。加好上、下槽电极缓冲液(Tris-甘氨酸),插上电极,上负下正。
2.将电流调至3mA/管,电压100~200V,当溴酚蓝追踪剂接近管底时(约电泳30分至1小时),切断电源,将凝胶管取出(缓冲液倒入回收杯)。
五、剥胶
取下凝胶管,用带有10cm长针头注射器,内盛蒸馏水作润滑剂,将针头插入胶柱与管壁之间,边注水边旋转玻璃管,直至胶柱与管壁分开,用洗耳球轻轻在一端加压,使胶柱从玻璃管中慢慢滑出。
六、染色与脱色
从管中取出凝胶柱浸入0.5%~1%氨基黑染液中,一般染色约10~15分钟,但有的蛋白质需要更长时间。染色后用水冲去多余的染料,放入7%乙酸中脱色,直至余下黑色全部脱去为止。约30分钟。
来源:丁香实验