如何确定蛋白是否正确折叠
wj0914
最近在做一个小分子多肽(4KD,含4个二硫键),采用的是构建到pet32a(含trx标签),然后BL21(DE3),37℃诱导5h得到融合蛋白(大约22KD)。现在遇到了以下问题
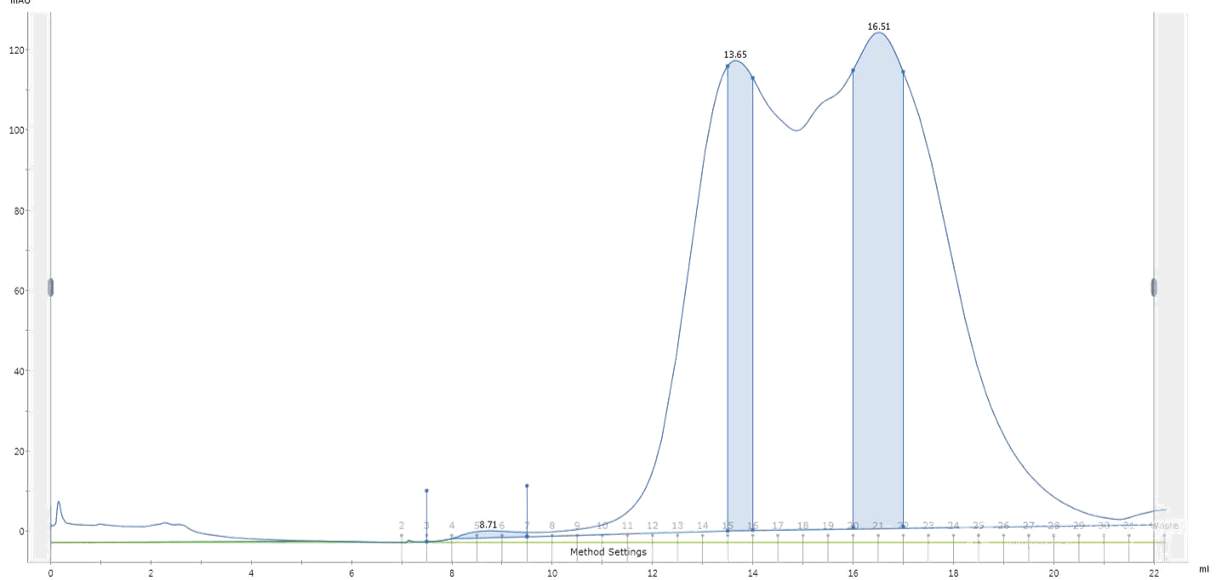
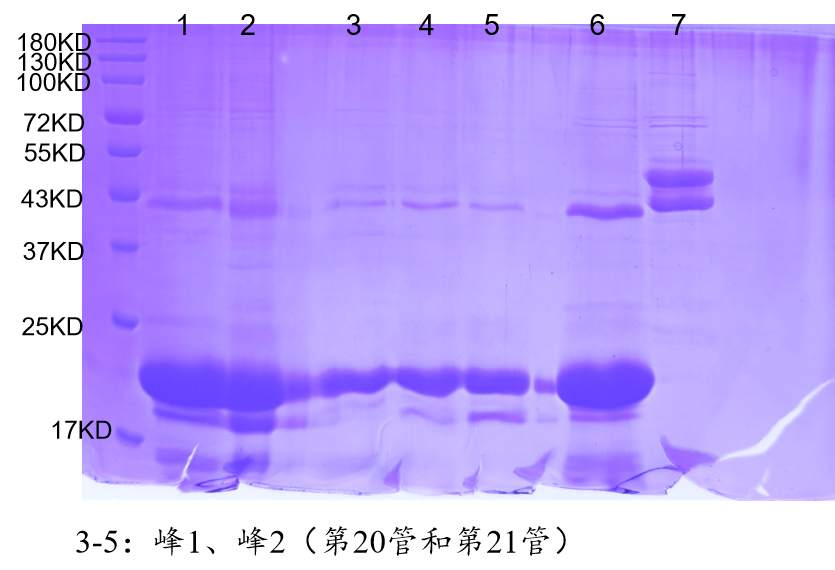
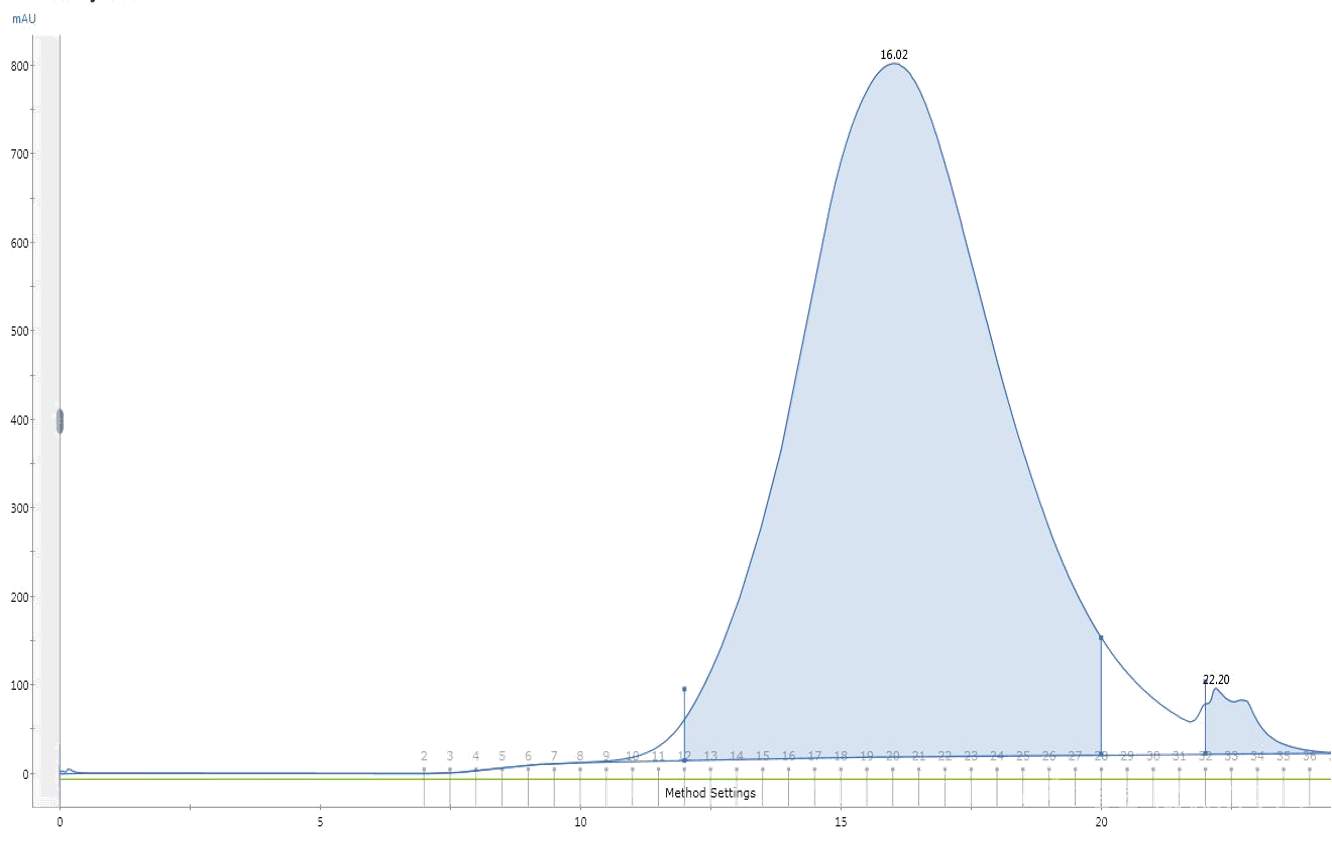
1、融合蛋白过分子筛峰(superdex200柱)很宽(5ml以上了),而且量少的时候发现其实是两个峰(一个14ml左右,一个17左右)重叠在一起了,所以导致峰宽。洗镍柱的咪唑用到了100mM,也并没有改善,两个峰几乎等比降低,低温诱导也是一样的。取两个峰跑胶,发现后面那个峰和前面峰条带几乎一样,只是多了一条分子量低了3-4KD的带(带相对来说较浅),想请问一下这两个峰是否是由于二硫键的不同折叠状态导致的?如果是的话,如何判断哪个峰才是正确折叠的呢?以及如何改善这种情况?
2、蛋白二硫键不正确折叠会影响后续其与另一个蛋白的结合吗?
分享
3 个回答
bamboopiggy
有帮助
你用的是原核表达系统,虽然原核系统的表达效率易于优化和调整,表达量高。但是当用于表达真核外源基因时,由于不同的蛋白质折叠和糖链修饰,其应用受到限制。所以我觉得你可以考虑换个真核表达系统试试
Eason老歌迷
有帮助
蛋白二硫键不正确折叠肯定会影响后续其与另一个蛋白的结合。即便是蛋白质氨基酸支架的微小改变,也会引发错误折叠并且妨碍蛋白质功能或引发疾病。
我记得中科院有一个项目就是如何确定蛋白是否正确折叠,你可以查查看。
天一湖医者
有帮助
第二个问题。蛋白二硫键不正确折叠会影响后续其与另一个蛋白的结合吗?
对蛋白质的高级结构会有影响的。如果这个蛋白质在肽链之间或肽链之内由二硫键连接成二级以上的高级结构的话,二硫键被破坏的话将影响蛋白质的结构。
相关产品推荐
提问
扫一扫
实验小助手
扫码领资料
反馈
TOP
打开小程序