蛋白纯化三条带?二分之一和二倍?
dxy_99zdlejq
蛋白纯化,包涵体表达,16℃ 24h诱导,8m尿素溶解变性,逐渐透析复性,因为镍柱是一毫升,所以纯化时采用流速0.5ml/min,收取26CV,但是蛋白胶page和WB跑出来都是三个条带,而且也很糊。不知道是什么原因,图中显示依次为Marker 空载对照 变性后未透析 透析复性后 流穿 4 5 6 7 8 这些数字为纯化出来的样品跑出来的,明明是在单一的一个峰值里面的,不知道为什么这么多带?我的蛋白大小39.3KDa,下面小的带接近20KDa ,高的带高于70KDa假设是80KDa的话,所以很像是一个是目的带的二分之一,一个又像是目的蛋白的两倍。求解?谢谢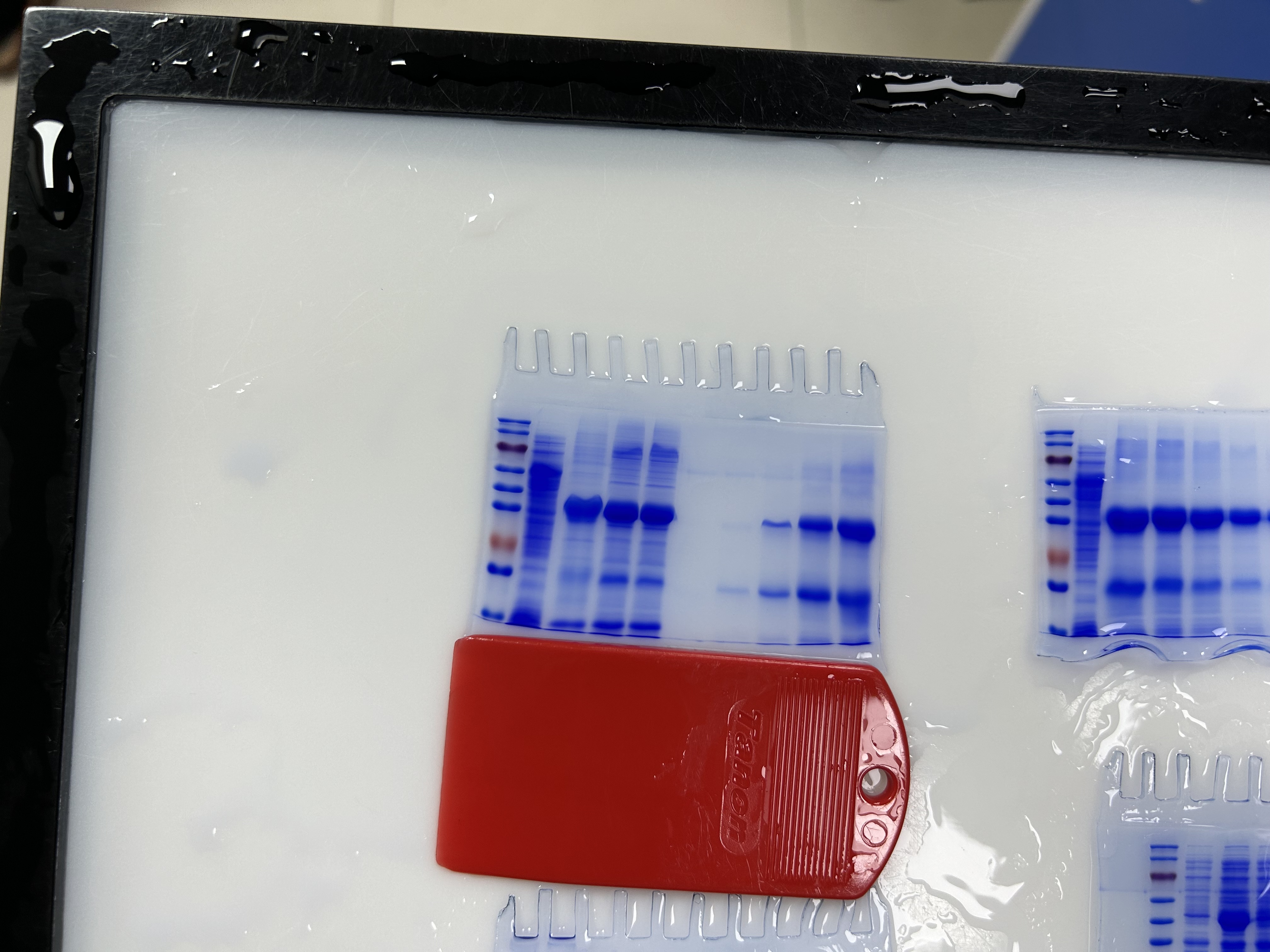
2 个回答
loveliufudan
可能是由以下原因导致的:
1.蛋白降解:在纯化和表达过程中,蛋白可能因降解酶的作用而被切割成较小的片段。这可能解释了为什么你观察到一个较小的条带(约20 kDa)。为了避免这种情况,可以在制备和处理蛋白样品的过程中添加一定的蛋白酶抑制剂。
2.蛋白聚合:另一个可能的原因是蛋白聚合。在你的描述中,你提到了一个高分子量条带(假设约80 kDa),这可能是目标蛋白的二聚体。可以尝试使用不同的表达条件、纯化方法或缓冲液,以优化蛋白质的溶解和复性过程,减少聚合的可能性。
3.非特异性结合:镍柱属于亲和层析方法,但有时可能会出现非特异性结合。在纯化过程中,某些非目标蛋白可能与镍柱产生弱相互作用,导致它们出现在纯化的蛋白样品中。尝试优化洗脱条件,如适当提高洗脱液中的imidazole浓度,以降低非特异性结合的可能性。
4.过载的凝胶:如果加载过多的蛋白质样品,SDS-PAGE和Western Blot可能会出现模糊的条带。检查加载的样品量,尝试减少样品量以获得更清晰的条带。
土井挞克树
你的条带有些复杂,可能有的存在降解有的还形成了多聚体