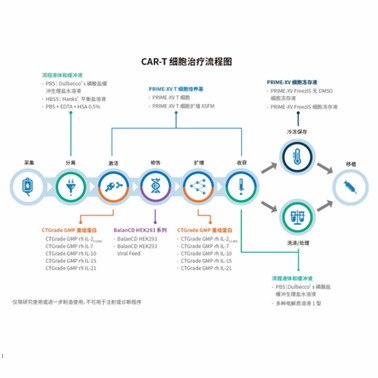
Science | 破除抑制性肿瘤微环境,改良 CAR-T 可靶向实体瘤
富士胶片生命科学
CAR-T 细胞疗法自 2017 年首次获得 FDA 批准以来一直蓬勃发展,在血液恶性肿瘤治疗上表现优异,为 B 细胞急性淋巴细胞白血病等疾病的患者提供了完全治愈的可能性。但大部分实体瘤由于肿瘤微环境的影响,会阻碍 T 细胞浸润、活化和增殖,导致对 CAR-T 疗法反应有限。其主要的抑制机制包括 T 细胞受体信号传导的抑制以及炎性细胞因子的消耗,目前克服抑制性肿瘤微环境仍然是实体瘤免疫治疗的主要障碍。
2022 年 12 月 16 日,Science 发文表示,研究人员通过在 T 细胞上构建肿瘤特异合成性 Notch 受体(synNotch),可以在识别癌细胞后诱导产生 IL-2 促进 T 细胞活性,在胰腺肿瘤和黑色素瘤模型中可以有效增强 CAR-T 细胞或 TCR-T 细胞的肿瘤浸润,实验鼠体内的肿瘤清除能力以及其存活率均有显著提升,此类改良给 CAR / TCR-T 细胞在免疫抑制性实体瘤治疗领域带来新突破。

图:论文截图
目前 CAR-T 细胞治疗血液恶性肿瘤也仍面对四个主要挑战:
- 肿瘤异质性以及目的抗原丢失
- 免疫抑制性的肿瘤微环境
- CAR-T 细胞耗竭
- 输注后的不良反应
面对这些挑战,研究者在 CAR 的结构设计方面进行了改进,包括:
- 配体受体亲和力的加强
- 共刺激分子的表达
- 细胞因子的自分泌
- 在异体疗法中删除 GvHD 相关基因
而对于输液后的不良反应,最常见的是细胞因子风暴(Cytokine Release Syndrome)和神经毒性,临床上主要通过 IL-6 受体的托珠单抗治疗来打破细胞因子的反馈循环,一般与皮质类固醇联合使用。
CAR-T 的体外培养的关键:细胞因子
在 CAR-T 体外扩增的阶段中,能够对体内的实际疗效造成影响的因素,除了 CAR 阳性率和输注细胞数这些基本指标之外,IFNγ 分泌量和肿瘤细胞杀伤实验也是必需的 CAR-T 成品的质量参数。然而,这些体外试验对于 CAR-T 成品实际的体内疗效的参考性是极为有限的。相对于这些体外试验,细胞输注至人体后 CAR-T 在血液中归巢 / 迁移的能力,在体内的扩增、分化潜能、留存周期,以及对癌细胞杀伤的能力才是决定 CAR-T 疗效的关键。
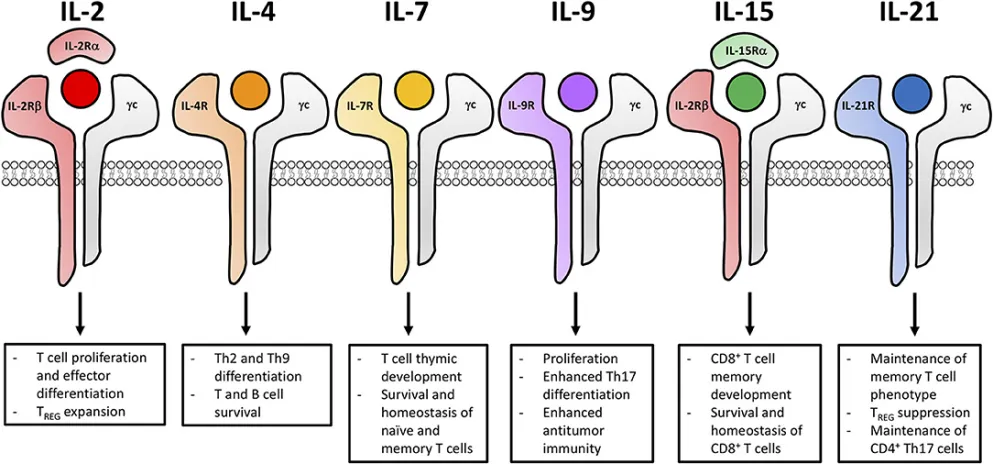
图:共同 γ 链细胞因子
而对于这些因素的优化,体外培养中的重组细胞因子方案起着决定性的作用。众所周知,T 细胞的功能、生存和增殖受到细胞因子信号的强烈影响。共同 γ 链(γc)细胞因子家族的成员,包括 IL-2,4,7,9,15,21,在促进 T 细胞生长、肿瘤杀伤以及驱动长效记忆反应等方面发挥着关键作用。
探索正确的细胞因子组合
IL-2 作为最常用且能够快速诱导 T 细胞扩增的白介素,在 CAR-T, TIL ,CIK 等淋巴细胞相关疗法中有着广泛的应用,对于 NK 细胞同样具有诱导活化扩增的能力。在最初一批 CAR-T 的上市产品中,IL-2 在生产流程中扮演着不可或缺的角色。
然而科学家们逐渐发现了单独使用 IL-2 进行体外扩增带来的负面影响:这种快速扩增方案在体外培养的过程中诱导了效应 T 细胞的终末分化,从而降低了它们在体内的长期存活率和抗肿瘤效果。并且 IL-2 在促进活化 T 细胞扩增的同时,同样能够促进调节性 T 细胞(Treg)的扩增和存活。Treg 作为免疫抑制性的 T 细胞表型,在体内的肿瘤微环境中会抑制 CD8+T 细胞对癌细胞的杀伤作用并抑制 CD8+ 记忆 T 细胞的分化。因此在体外培养的过程中控制 Treg 细胞的比例也成为了课题之一。
由于 IL-2 这些潜在的负面影响,在当今的 CAR-T 开发中,相较于 CAR-T 细胞的扩增数和阳性率,如何提高 CAR-T 在体内的疗效和留存时间逐渐成为研究的重点,多种白介素的搭配使用也在实际生产中受到重视。
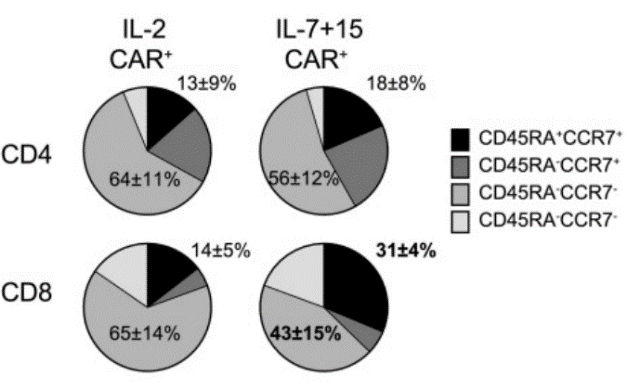
图:使用 IL-7 和 IL-15 代替 IL-2 进行 CAR-T 的离体扩增
细胞因子灵活搭配使用达到疗效最大化
对小鼠和非人灵长类动物过继性 T 细胞迁移的研究表明,虽然效应记忆 T 细胞具有强大的癌细胞杀伤功能,但中央记忆 T 细胞和其他分化程度较低的 T 细胞亚群如幼稚 T 细胞,对 CAR-T 的体内扩增、存活和长期持久性至关重要。
2014 年由 Yang Xu 等人刊登在 Blood 杂志上的临床试验论文证明了使用 IL-7 和 IL-15 代替 IL-2 的 CAR-T 离体扩增能够带来体内疗效上的优势。该论文证实了患者体内的 CAR-T 细胞扩增水平与 CCD45RA、CCR7 双阳性杀伤性 T 细胞的比例呈正相关。在体外扩增流程中,相较于 IL-2,添加 IL-7 和 IL-15 共孵育的 CAR-T 细胞中含有更高比例的 CD45RA、CCR7 双阳性杀伤性 T 细胞。
从上图我们可以看到在 IL-2 单独孵育后的 CAR+ 杀伤性 T 细胞中,CD45RA、CCR7 双阳性率为 14+-5%,而在 IL-7,IL-15 细胞因子组合共孵育的杀伤性 T 细胞中双阳性率达到了 31+-4%。同样的,IL-21 也被证明能够增强抗原刺激后 CAR-T 细胞的扩增,降低 CAR-T 细胞在与肿瘤细胞共培养过程中的凋亡水平,并抑制 CAR-T 细胞向后期表型的分化。在与 IL-2 共培养期间,IL-21 增强了中央记忆 CAR-T 细胞的扩增,而 IL-2 的单独孵育会促进耗竭标志物 PD-1 的上调。
![VX2[暂不提供]兔实体瘤细胞](https://img1.dxycdn.com/p/s14/2025/0630/296/8210257128098159391.jpg!wh200)