3D 生物打印:生物墨水选择指南
默克生命科学
2644
何为 3D 生物打印?
3D 生物打印指通过设计类组织复杂程度的体模形基质,生成精确控制的 3D 细胞模型和组织结构。由于底物与成分高度可控,3D 生物打印有望满足许多药物研究未竞的关键需求,包括在化妆品检测、药物研究、再生医药和功能性器官置换等应用领域的需求。使用诱导性多能干细胞(iPS 细胞)或间充质干细胞等患者源性干细胞可以创造出个性化的疾病模型。根据具体应用,可通过一系列材料、方法和细胞创造理想的组织结构(图 1)。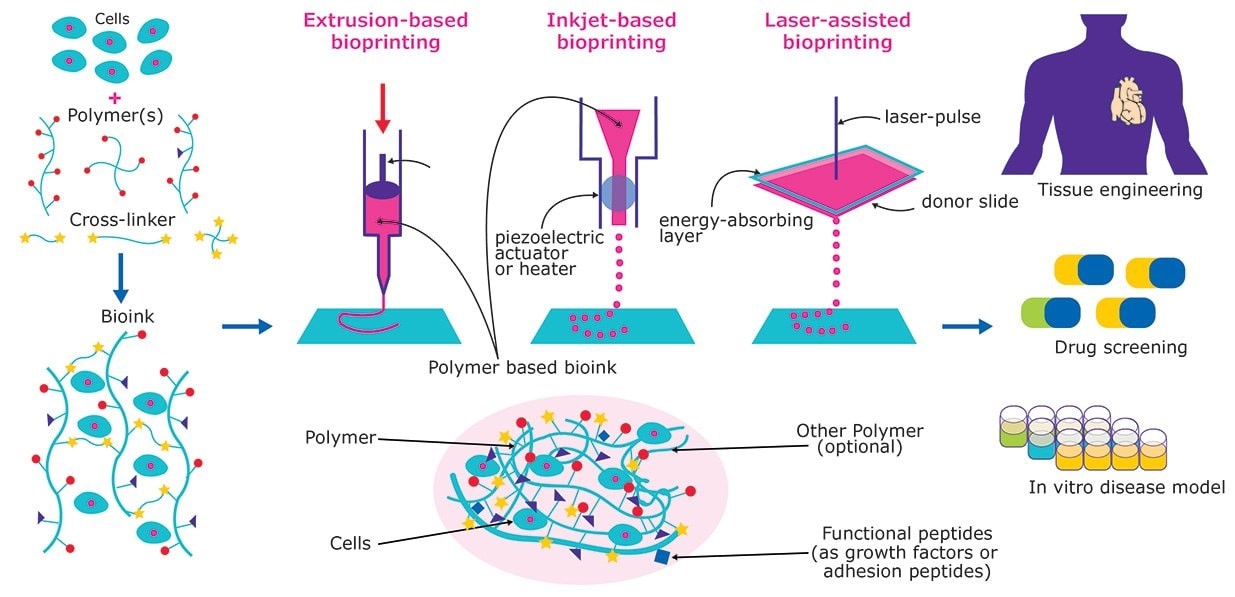
图1.组织与器官的3D生物打印。生物墨水通过结合培养的细胞和各种生物相容材料制成,随后3D生物打印进功能组织结构,以便进行药物筛查、疾病建模和体外移植。
何为生物墨水?
生物墨水包括活细胞和生物材料,能模拟胞外基质环境,,打印后支持细胞黏贴壁、增殖和分化。与传统3D打印材料不同,生物墨水必须满足:- 打印温度不超过生理温度
- 交联或称胶条件温和
- 生物活性成分无毒,且打印后能被细胞改性
在3D生物打印中,细胞封装水凝胶通过形成多细胞生物打印合成砌块,创造活体组织结构。相较于其他方法与材料,细胞封装可精准控制支架内的细胞附着,以及细胞和生物分子空间分布。1 结合规定模式的多种细胞类型和生长因子,可以得到高度复杂的组织结构。除生物相容性之外,用于细胞封装的生物打印材料必须具有高含水量和多孔性,方便封装细胞吸收营养、排出废物。1 作为水溶胀性多孔网络,水凝胶是细胞封装、组织建造和3D生物打印的理想材料。3D生物打印所用的水凝胶还必须具有可调底物刚度且打印后可重构网络,从而方便细胞散播、迁移、增殖和互作。在用作生物墨水的一众材料中,最受欢迎的材料包括明胶甲基丙烯酸(GelMA)、胶原蛋白、聚合酶(乙二醇)(PEG)、Pluronic®、褐藻酸盐,以及基于脱细胞胞外基质(ECM)的材料(表1)。
推荐生物墨水材料:明胶甲基丙烯酸(GelMA)
明胶甲基丙烯酸(GelMA)可用于形成交联水凝胶,适用于组织工程和3D打印。基于GelMA的生物墨水具有优异的细胞亲和性、可调底物刚性、适印性更好、暴露于紫外线或可见光可迅速交联(具体取决于光敏引发剂特性)。GelMA已用于皮内细胞形态发生、心肌细胞、表皮组织、可注射组织结构、骨分化和软骨再生。明胶甲基丙烯酸还在药物递送用的微球和明胶上有所应用。
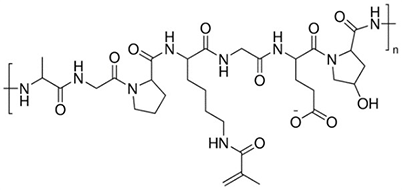
图2.明胶甲基丙烯酸
脱细胞材料:结构支架和聚合物
除生物墨水外,脱细胞材料也用于3D生物打印结构。脱细胞材料通常为组织结构提供结构支持;结合生物墨水使用时,可生成功能性的生物打印组织。脱细胞材料是可同时重塑天然胞外基质(ECM)机械和生化性能的多孔物质。这些结构的多孔构造支持细胞迁移、组织生长、血管成形并保持细胞活性。除此之外,脱细胞材料还必须具有支持细胞附着、增殖和分化的表面化学特性。常用脱细胞材料包括:胶原蛋白、纤维蛋白、甲壳胺纳米纤维素、聚合酶(乙二醇)(PEG)、聚已内酯(PCL)、羟基磷灰石(HA)、β-磷酸三钙(β-TCP)(表1)。
生物墨水材料合成砌块
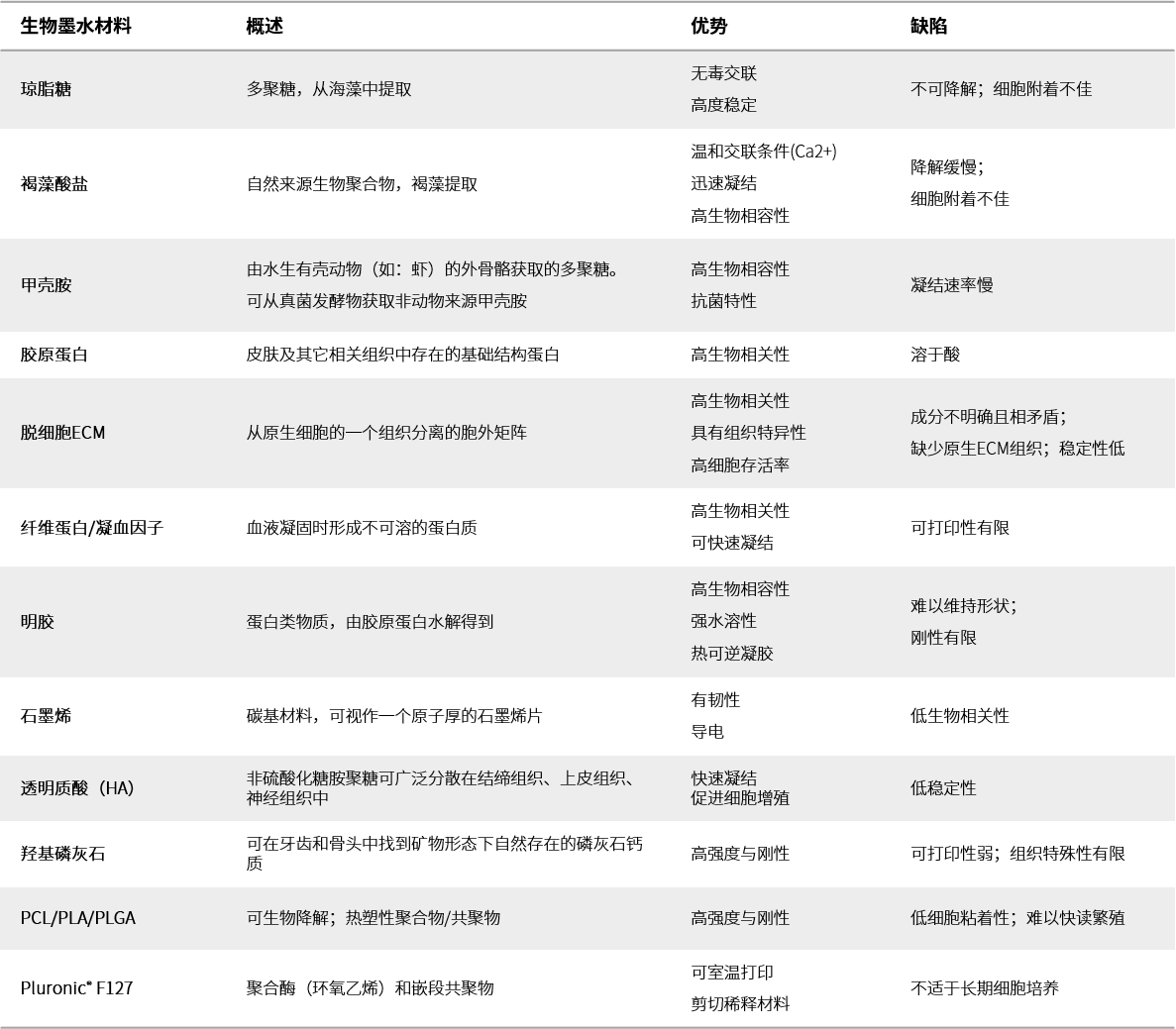
表1:3D生物打印常用生物材料。
应使用哪些3D生物打印方法?
根据选择的墨水类型(生物墨水或脱细胞材料)和最终组织结构的复杂性,可以使用不同的 3D打印方法(图 1)。常见方法的优缺点见下表(表 2)。表 2.3D 生物打印方法概述.

除墨水类型之外, 生物打印方法还取决于打印结构体的最终应用 (表 3)。
组织工程应用
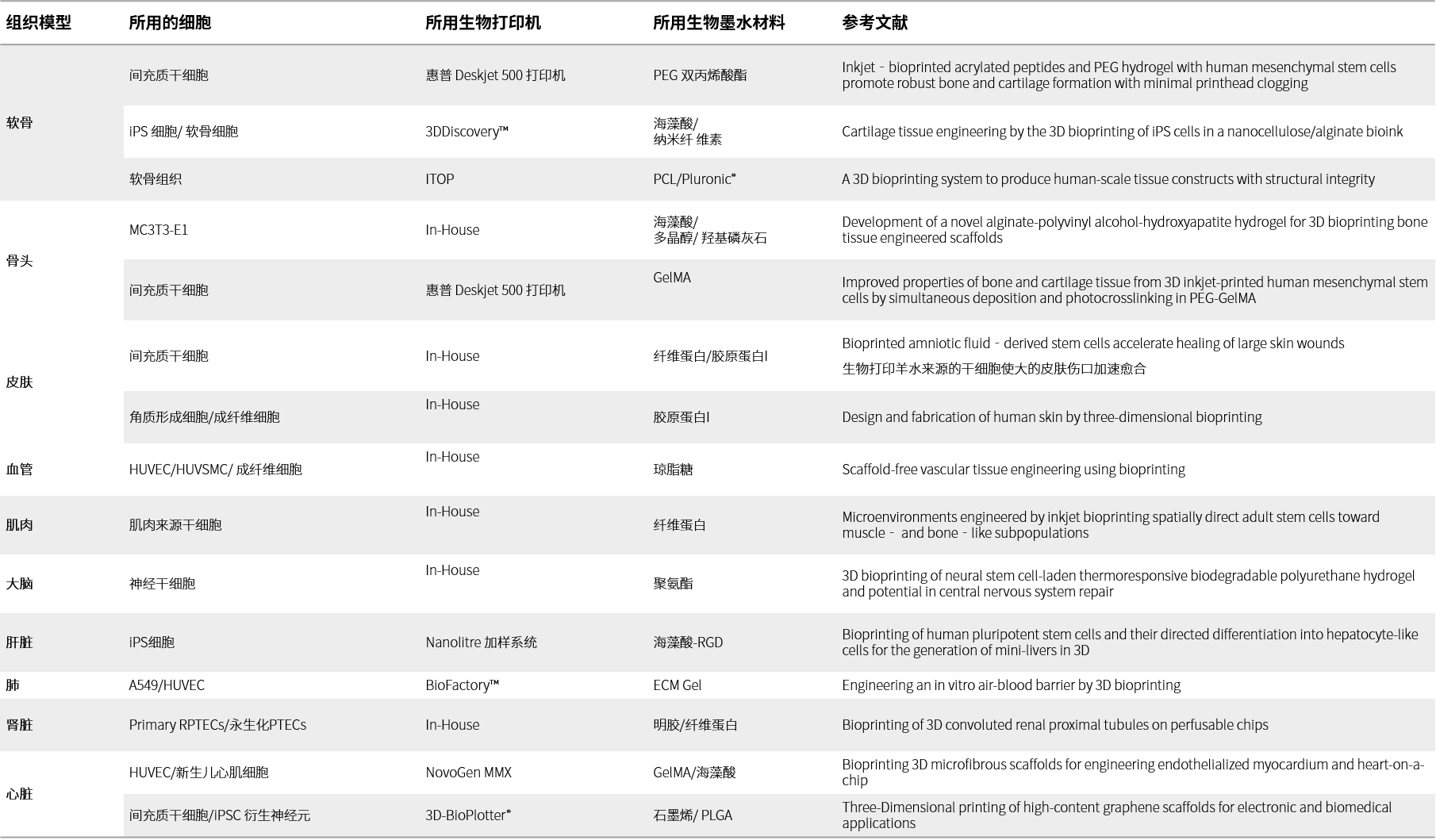 表 3.组织结构的3D生物打印.
表 3.组织结构的3D生物打印.
结论
3D生物打印可在明确的3D 微环境中,让细胞实现空间可控分布。生物墨水通过组合细胞和各种生物相容性材料制成,然后打印成特定形状的类组织3D结构。Sigma-Aldrich结合自身在材料科学和 细胞生物学方面的专业知识,提供了多种简化3D生物打印工作流程的解决方案。References
1.Pan C, Bruyas A, Yang Y. 2016. Material Matters.. 11(2):49-55.2.Sears NA, Seshadri DR, Dhavalikar PS, Cosgriff-Hernandez E. 2016. A Review of Three-Dimensional Printing in Tissue Engineering. Tissue Engineering Part B: Reviews. 22(4):298-310. http://dx.doi.org/10.1089/ten.teb.2015.0464
3.Langer R, Vacanti J. 1993. Tissue engineering. Science. 260(5110):920-926. http://dx.doi.org/10.1126/science.8493529
4.Bose S, Vahabzadeh S, Bandyopadhyay A. 2013. Bone tissue engineering using 3D printing. Materials Today. 16(12):496-504. http://dx.doi.org/10.1016/j.mattod.2013.11.017
5.Hutmacher DW. 2000. Scaffolds in tissue engineering bone and cartilage. Biomaterials. 21(24):2529-2543. http://dx.doi.org/10.1016/s0142-9612(00)00121-6
6.Bose S, Roy M, Bandyopadhyay A. 2012. Recent advances in bone tissue engineering scaffolds. Trends in Biotechnology. 30(10):546-554. http://dx.doi.org/10.1016/j.tibtech.2012.07.005
7.Lichte P, Pape H, Pufe T, Kobbe P, Fischer H. 2011. Scaffolds for bone healing: Concepts, materials and evidence. Injury. 42(6):569-573. http://dx.doi.org/10.1016/j.injury.2011.03.033
8.Lu L, Zhang Q, Wootton D, Chiou R, Li D, Lu B, Lelkes P, Zhou J. 2012. Biocompatibility and biodegradation studies of PCL/?-TCP bone tissue scaffold fabricated by structural porogen method. J Mater Sci: Mater Med. 23(9):2217-2226. http://dx.doi.org/10.1007/s10856-012-4695-2
9.Elomaa L, Kang Y, Seppälä JV, Yang Y. 2014. Biodegradable photocrosslinkable poly(depsipeptide-co-?-caprolactone) for tissue engineering: Synthesis, characterization, and In vitro evaluation. J. Polym. Sci. Part A: Polym. Chem.. 52(23):3307-3315. http://dx.doi.org/10.1002/pola.27400
10.Elomaa L, Pan C, Shanjani Y, Malkovskiy A, Seppälä JV, Yang Y. Three-dimensional fabrication of cell-laden biodegradable poly(ethylene glycol-co-depsipeptide) hydrogels by visible light stereolithography. J. Mater. Chem. B. 3(42):8348-8358. http://dx.doi.org/10.1039/c5tb01468a
11.Yue K, Trujillo-de Santiago G, Alvarez MM, Tamayol A, Annabi N, Khademhosseini A. 2015. Synthesis, properties, and biomedical applications of gelatin methacryloyl (GelMA) hydrogels. Biomaterials. 73254-271. http://dx.doi.org/10.1016/j.biomaterials.2015.08.045