抗体的概念、产生机制及结构
丁香实验
抗体的概念
抗体(antibody, Ab),也叫免疫球蛋白(immunoglobulin, Ig),是血液和组织液中的一类糖蛋白,由B细胞接受抗原刺激后增殖分化成的浆细胞产生,能与相应抗原特异性地结合,是介导体液免疫的重要效应分子。1968年和1972年世界卫生组织和国际免疫学联合会的专门委员会先后决定,将具有抗体活性或化学结构与抗体相似的球蛋白统称为免疫球蛋白。后来研究证实,Ig和Ab在结构及功能上完全一致,因此可认为二者的概念等同。Ig可分为分泌型和跨模型,前者主要存在于血液和组织液中,发挥各种免疫功能;后者则是构成B细胞表面的抗原受体。我们常说的抗体其实就是分泌型的Ig。
抗体的产生机制
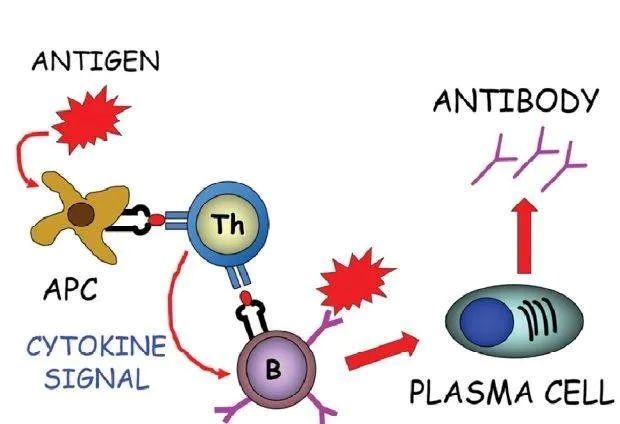
图1:抗体产生机制示意图
B淋巴细胞通过B细胞受体(BCR)识别抗原,抗原提呈细胞(APC)对抗原进行摄取、加工、递呈,辅助性T细胞(Th)被APC激活后分泌多种细胞因子与B细胞上的细胞因子受体结合并相互作用向B细胞提供协同刺激信号。一旦受到刺激,B细胞开始分裂,最终转化为可分泌抗原特异性抗体的浆细胞。
抗体的基本结构
所有Ig的单体结构非常类似,由两条重链和两条轻链组成,重链之间及重链和轻链之间由二硫键连接,形成的构象与英文大写字母“Y”类似。根据重链的不同将Ig分为5个同种型(isotype),分别是IgG、IgA、IgM、IgD和IgE。其中IgG、IgD和IgE只有单体形式,而IgA和IgM具有由数个相同单体组成的多聚体形式。
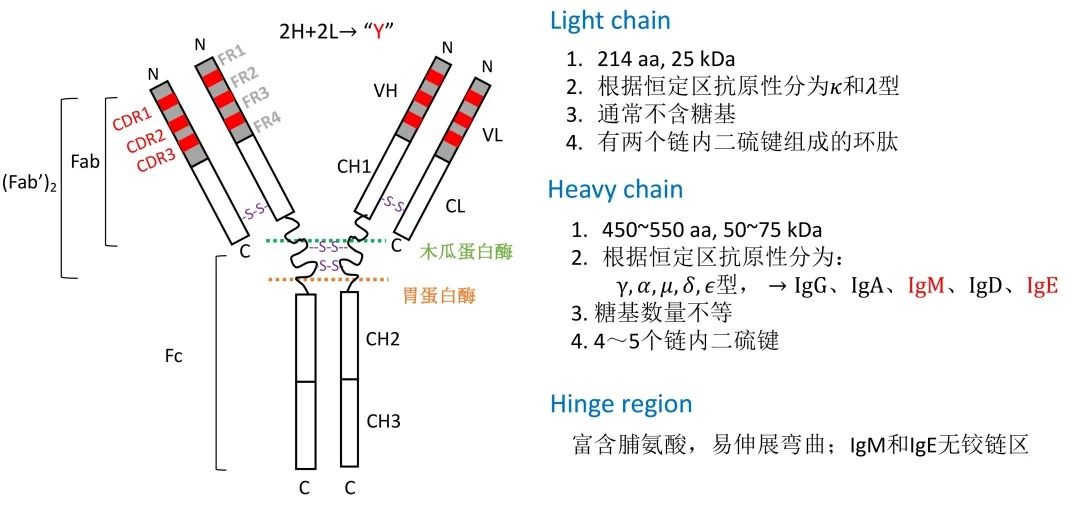
图2:抗体结构示意图
Ig轻链和重链中氨基酸序列变化较大的区域称为可变区(variable region, V),氨基酸序列较保守的区域称为恒定区(constant region, C)。重链和轻链可变区(VH和VL)各有3个区域的氨基酸组成和序列高度可变,称为高变区或互补决定区(complementarity determining region, CDR),分别为CDR1、CDR2和CDR3。CDR以外区域的氨基酸组成和排列顺序相对不易变化,称为骨架区(framework region, FR)。正是VH和VL的3个CDR在空间上形成了特定构象,从而识别和结合抗原,发挥免疫效应,Ig的恒定区则与抗体的生物学效应相关。