AD 的常见蛋白标志物及其研究进展
丁香实验
一、阿尔兹海默病
阿尔茨海默病(AD)是一种神经退行性疾病,影响着全世界数百万人,且几乎没有有效的治疗方法。其特征包括进行性认知能力下降,包括记忆障碍、定向障碍、语言障碍和行为异常,这不可逆地降低了患者的独立日常生活能力。AD 的发展可分为三个阶段:临床前 AD,轻度认知障碍和痴呆。其主要病理特征包括淀粉样蛋白 β(Aβ)斑点在大脑皮层和海马体中的沉积、tau 蛋白过度磷酸化所形成的神经元纤维缠结(NFT)和神经炎症。这些神经病理学变化可能在 AD 症状出现前几年就有所展现,因此,以上特征的早期诊断和治疗对 AD 的防治具有重要的临床意义。
二、AD 诊断的常见蛋白标志物
对于 AD 的早期诊断和疾病风险评估,生物标志物的检测是一项重要指标。关于 AD 发病机制的各种假设导致了许多不同类型的生物标志物的发展,其中更是以 Aβ 寡/多肽、tau 蛋白和载脂蛋白 E(ApoE)的衍生物为主。
1、淀粉样蛋白 β(Aβ)
Aβ 肽是由淀粉样前体蛋白(APP)经过 β 和 γ 分泌酶相关的一系列剪切事件后产生的,通常由 38‒42 个氨基酸组成,分子量约 4 kDa。Aβ1-40 和 Aβ1-42 是 Aβ 蛋白的两种最重要的亚型,Aβ1-40 的含量最为丰富。Aβ1-42 倾向于聚集并产生更明显的神经毒性,是第一个显示明显异常的生物标志物。Aβ 单体的聚集可以产生不同类型和大小的聚集体,其中可溶性 Aβ 低聚物的神经毒性更大。
2、Tau 蛋白
Tau 蛋白是一种微管相关蛋白,分子量 50‒75 kDa,主要位于神经元轴突中,是维持骨骼神经元系统稳定性所需的重要分子。正常情况下,其与微管蛋白结合,促进微管的聚合和稳定。然而,在 AD 患者体内,Tau 的过度磷酸化将其从可溶性变为不溶性,导致 NFT 的形成,最终导致神经细胞功能丧失甚至死亡,尤以 pTau181 脑脊液浓度的改变最为显著。近年来,pTau231、pTau217、也被认为是有前途的 pTau 标志物。此外,Aβ 的神经毒性需要由 tau 蛋白介导,研究表明,Tau 缺陷动物可以免受 Aβ 诱导的毒性,表明 Tau 依赖性树突信号在介导 Aβ 毒性中起着关键作用。
3、载脂蛋白 E(ApoE)
ApoE 是大脑中主要的脂质转运蛋白,由星形胶质细胞产生,并通过 ApoE 受体将胆固醇转运到神经元,用以支持神经再生和修复 AD 相关的周围神经损伤。ApoE 的主要亚型是 ApoE2、3 和 4,其中,ApoE4 与 Aβ 导致的神经病理学密切相关,并且是散发性 AD 的最强遗传危险因素之一,ApoE4 的存在也会加剧 tau 诱导的脑损伤。
4、其它标志物
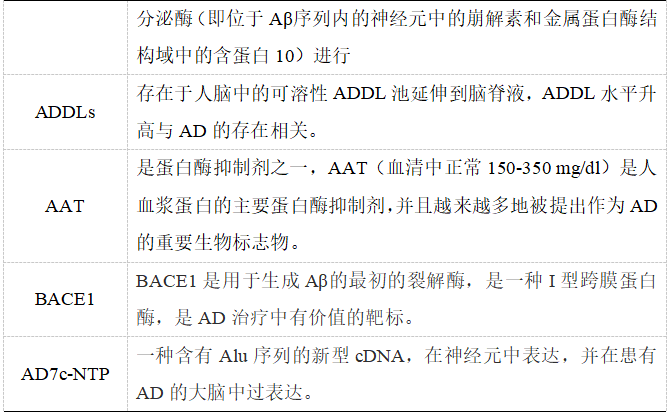
APP、淀粉样蛋白 β 衍生的扩散配体(ADDLs)、α-1 抗胰蛋白酶(AAT)、BACE1 和阿尔茨海默症相关神经元线蛋白(AD7c-NTP)已被公认为 AD 早期诊断的有效生物标志物。
表1. AD生物标志物及其在疾病中的作用
三、AD蛋白标志物的检测
1、常规方法
用于鉴定 AD 蛋白标志物的常规方法主要包括酶联免疫吸附测定(ELISA)、免疫印迹(WB)和质谱法(MS)等,主要针对 Aβ 和 tau 蛋白的检测。
① ELISA 相对来说操作最为简单,但是存在灵敏度低,易出现假阳性的缺点;
② WB 灵敏度相对较高,但设备昂贵,操作耗时;
③ MS 是三者中灵敏度最高的检测手段,但同样存在设备昂贵,操作耗时的问题。
2、生物传感器
通过结合常规方法,生物传感器可以在体内或体外环境中以高灵敏度量化生物标志物,并实现实时监测。生物传感器的设计主要取决于生物识别元件和信号转导。生物识别元件包括:免疫传感器、酶、基于蛋白质/肽、基于基因的生物传感器和全细胞生物传感器;信号转导包括:电化学、光学、热传感器和质量传感器。由此开发的光学和电化学平台具有灵敏度高、重现性好、性价比高、使用方便等特点,更加适用于临床应用。
2.1 光学分析平台
根据光学传感平台的原理和方法,将其分为单分子阵列(Simoa)、表面等离子体共振(SPR)、表面增强拉曼光谱(SERS)。
① Simoa 是一种基于单分子免疫分析技术的高灵敏度蛋白质检测和研究诊断平台,可以分析多种 AD 生物标志物。其技术的原理是基于 ELISA 双抗体夹心方法,能够在飞升大小的孔中捕获单个分子,并通过“数字”读出其中的珠子是否与其对应的分析物结合。
② SPR 是一种强大的光学检测技术,可用于实时研究无标记生物分子之间的相互作用。光源穿过棱镜,从检测表面的背面反射,然后进入检测器。在一定的入射角下,光被传感器芯片金属膜中的电子吸收,引起共振。由于反射光束强度的损失,它表现为暗带,可以看作是 SPR 反射强度曲线的下降。由于 SPR 浸渍的形状和位置可用于传达有关传感器表面的信息,因此 SPR 可用于研究游离分析物分子和溶液之间的分子相互作用,以及与固定在传感器表面上的探针分子的分子相互作用。
③ SERS 是一种振动光谱技术,已被应用于检测 Aβ 肽和 t-tau 蛋白,灵敏度低至单分子水平。基于 SERS 的独特性质,分析物的化学键信息,如酰胺I带(拉曼峰在∼1650 cm−1处)、组氨酸带(拉曼峰在 ∼1440 cm−1处)和蛋白质-CN 条带(拉曼峰在∼1090 cm−1),从而获得 AD 相关蛋白标志物与相应抗体的特异性结合。
2.2 电分析平台
检测 AD 生物标志物最常用的电分析方法包括伏安法/安培法,差分脉冲伏安法(DPV)和电化学阻抗谱(EIS)。
① 伏安法通过测量传感器电流在定义的偏置电位下的变化来监测 AD 生物标志物和识别元件之间的特异性结合。
② DPV 是指叠加在电位线性扫描上的一系列规则电压脉冲。电流在每个电位变化之前立即测量,电流差被绘制为电位的函数。探针与 Aβ 低聚物结合时,接收到的信号强度会降低,在线性范围 0.5–500 fM 内可实现有效检测,检测限为 0.25 fM。
③ EIS 分析生物传感器在 AD 生物标志物和受体之间特定相互作用中的电阻和电容特性,阻抗值通常符合 Randle 等效电路并生成 Nyquist 图。Nyquist 曲线半圆形部分的直径对应于 Rct,Rct 是用于评估分析物-生物传感器结合的参数,在氧化还原介质中随着 tau浓度(10−14 到 10−7 M范围内)增加。
3、结合影像学的 AD 精准诊断
3.1 常规影像学手段
Aβ斑块的正电子发射断层扫描(PET)和磁共振成像(MRI)是商业临床 AD 诊断中诊断 AD 的常用方法,使用 Aβ 和 tau靶向放射性示踪剂的 PET 成像可以在体内识别和量化这些病理蛋白。与 PET 成像相比,MRI 成像具有空间分辨率高、对比度高等优点,它不需要注射放射性药物,扫描成本相对便宜。但 MRI 图像通常具有高维度,增加了数据处理的复杂性。
3.2 多模态成像技术
多模态成像进一步优化了诊断的准确性。目前已开发出了定量高分辨率共聚焦显微镜和超分辨率随机光学重建显微镜(STORM)、双光子超分辨率受激发射损耗(2P-STED)显微镜、多光谱光声层析成像(MSOT)技术、微光学切片断层扫描(MOST)成像系统和化学切片荧光断层扫描(CSFT)等技术手段,实现病灶细节进行高分辨成像。
3.3 探针分子
探针的开发对于成像技术的发展是不可或缺的。针对 AD 病理蛋白结构,开发了近红外荧光(NIRF)探针,其显著降低了背景干扰,提高了灵敏度,增强了组织穿透力,成为了临床应用的理想选择。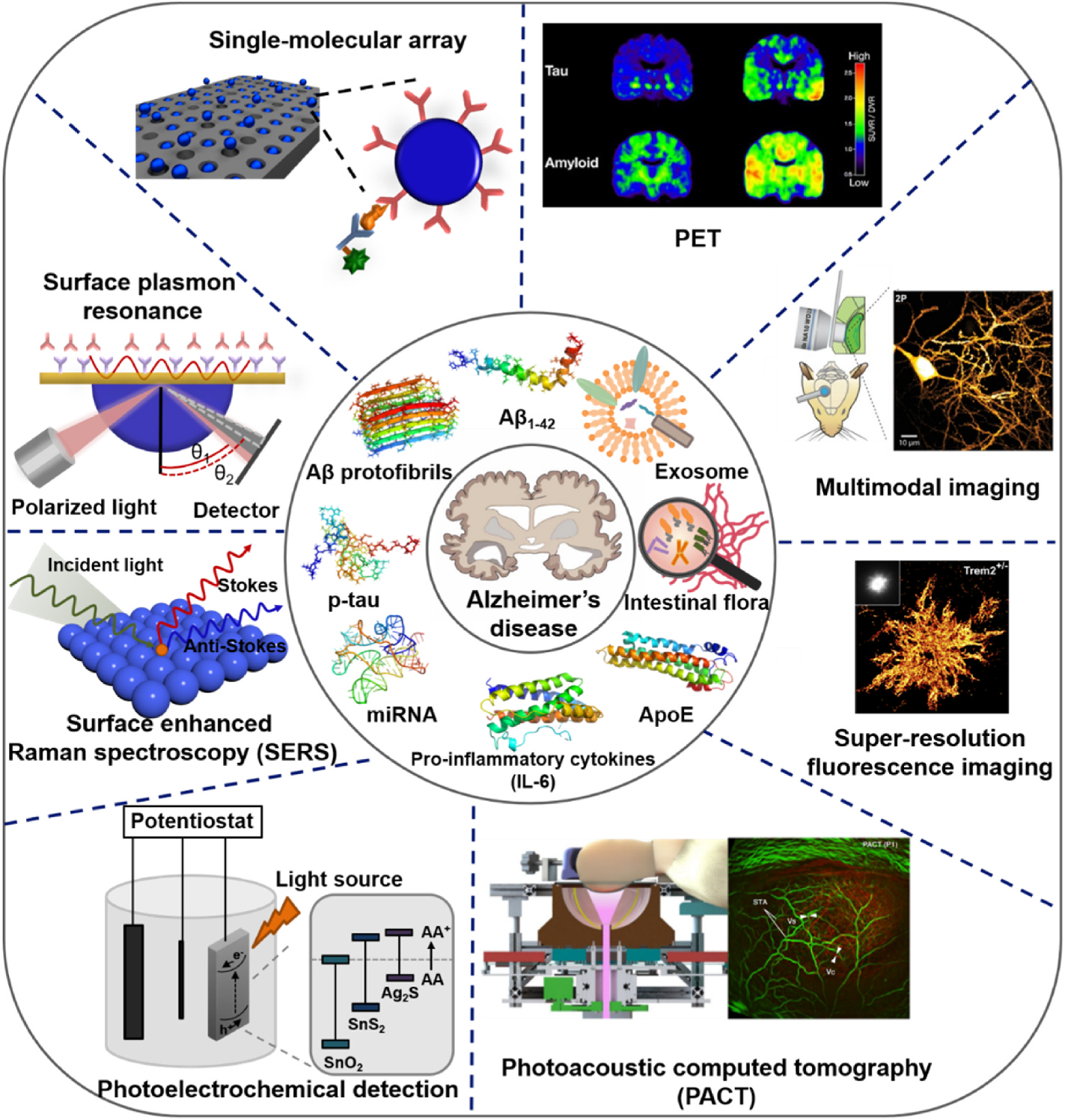
图1. AD相关的生物标志物及其检测手段。
四、参考文献
[1] Hu, S.; Yang, C.; Luo, H., Current trends in blood biomarker detection and imaging for Alzheimer's disease. Biosens Bioelectron 2022, 210, 114278.
[2] Mobed, A.; Hasanzadeh, M., Biosensing: The best alternative for conventional methods in detection of Alzheimer's disease biomarkers. Int J Biol Macromol 2020, 161, 59-71.
[3] Shui, B.; Tao, D.; Florea, A.; Cheng, J.; Zhao, Q.; Gu, Y.; Li, W.; Jaffrezic-Renault, N.; Mei, Y.; Guo, Z., Biosensors for Alzheimer's disease biomarker detection: A review. Biochimie 2018, 147, 13-24.
[4] Bhujbal, S. S.; Kad, M. M.; Patole, V. C., Recent diagnostic techniques for the detection of Alzheimer's disease: a short review. Ir J Med Sci 2022.
[5] Teunissen, C. E.; Verberk, I. M. W.; Thijssen, E. H.; Vermunt, L.; Hansson, O.; Zetterberg, H.; van der Flier, W. M.; Mielke, M. M.; Del Campo, M., Blood-based biomarkers for Alzheimer's disease: towards clinical implementation. Lancet Neurol 2022, 21 (1), 66-77.

![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)






