慢病毒原来可以这样用!
吉凯基因
慢病毒(Lentiviral,LV)可将外源基因有效地整合到宿主染色体上,从而实现持久性表达,这一特性使其在科研与临床治疗(CART)中大放异彩。
但在临床治疗中,外源基因的整合会带来插入突变的风险。这种情形下,研究者开始拓展非整合慢病毒的可能性。
IDLV(Integration-deficient Lentiviral) 即整合缺陷型慢病毒,是通过在慢病毒整合酶中引入突变产生的非整合型慢病毒,「不整合」的特性使其更适合于静息细胞、临床治疗、干细胞研究等场景使用。
与其他载体相比,其优势为:

此外,IDLV 可在分裂细胞中瞬时表达,非分裂细胞中稳定表达;并且可与任何慢病毒载体配套使用,产生非整合型的慢病毒。
IDLV 的应用场景
IDLV 在应用中有什么优势呢?适用于哪些研究呢?
- IDLV-CRISPR / Cas9高精准地进行基因编辑
CRISPR / Cas9 是基因组编辑领域的明星技术,目前慢病毒载体(LV)是递送 CRISPR / Cas9 组分的重要手段,LV 可容纳大的 DNA 载荷并有效转导分裂和非分裂细胞,适用于绝大多数的科学研究。然而,持续表达的 CRISPR / Cas9 可能促进脱靶效应,这阻碍了其应用于需要高精确度的基因组编辑。而 IDLV 适合递送 Cas9 组分至静息细胞,更适合临床研究,目前已有相关研究成果发表。
作者设计了针对 GFP 的靶点,分别以 LV、IDLV 感染 HEK293T 细胞,在第 7 天提取细胞做全外显子组测序(WES)分析,鉴定出了 16 个基因存在脱靶 4:

载体构建示意图
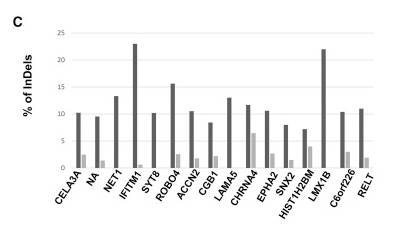
WES 鉴定脱靶的基因
LV 诱导的插入缺失的频率在 3.4%-24%(深线),而 IDLV 显示出较弱的诱导脱靶插入缺失的能力 0%-6.5%(浅线)。这些结果表明:虽然瞬时表达的 IDLV-CRISPR/Cas9 也能诱导脱靶突变,但其脱靶率显著低于 LV-CRISPR/Cas9。如果想实现高精准度的基因编辑,IDLV-CRISPR/Cas9 是一个不错的选择。
- IDLV 介导基因组无痕编辑
改变生物体的遗传密码以产生某些理想的结果是基因工程的目标,基因编辑包含三大技术:锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)、CRISPR/Cas9;使用 IDLV 递送这些组分可以实现无编辑工具基因组的痕迹残留,从而减少对原始细胞表型和活力的影响,更加避免了后续用于基因治疗的不确定性。
研究人员将 IDLV 与 ZFN、TALEN 结合,分别论证了 IDLV 递送这些常用基因编辑工具的有效性以及无痕编辑,更多的研究结果请参考文章5。此种应用的代表是 Cellectis 公司的 UCART6:通过 TALEN 基因编辑技术,敲除TCR等相关基因,避免免疫排斥,敲除PD1等免疫检查点,进一步增强CAR-T细胞的功能。因此,IDLV结合基因编辑工具在基因治疗领域有广阔的应用前景。
3.IDLV介导分化细胞的鉴定分离
人多能干细胞(hPSCs)在再生医学中的应用前景广阔。然而,必须通过移植特定细胞类型的同源群体确保 hPSC 衍生物的安全性。采用常规方法纯化从胚胎或诱导的多能干细胞产生的祖细胞和成熟细胞仍然具有挑战性,而 IDLV-GFP 报告系统可以解决这一难题:
作者构建IDLV表达肝脏特异性载脂蛋白A-II(APOA-II)启动子驱动绿色荧光蛋白,感染由人胚胎干细胞系分化的肝祖细胞进行分选,获得了富含肝祖细胞的细胞群3。
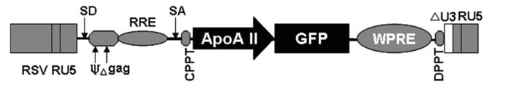
载体构建示意图
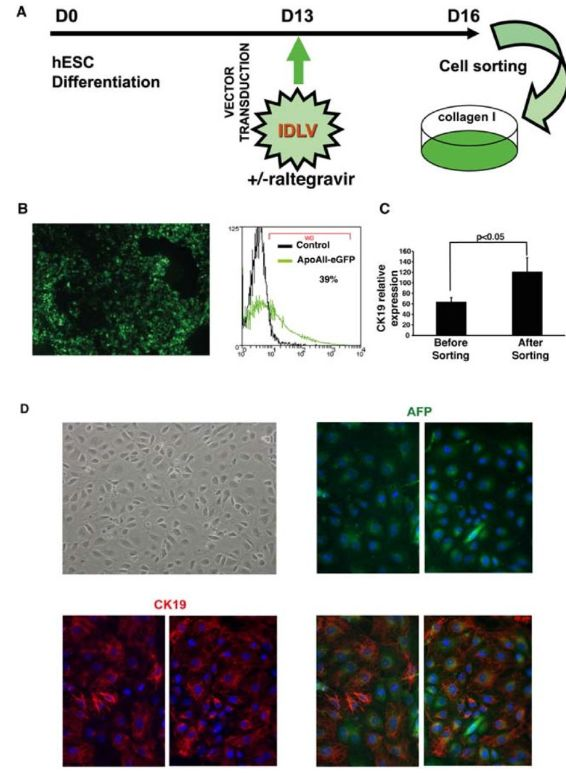
FACS 及标志物鉴定
(A)纯化肝祖细胞的方案的流程图。
(B)IDLV-APOA-II-GFP感染分化第 13 天的细胞群,在第 16 天对细胞群通过免疫荧光显微术(左图)以及 GFP 荧光分析-活化细胞分选(FACS)分析(右图)。
(C)通过定量逆转录(qRT)-PCR分析,在分选之前和之后(分别于分化的第13天和第16天)分别测定肝祖细胞中的细胞角蛋白(CK)19转录物水平。
(D)将人胚胎干细胞(hESC)衍生的肝祖细胞的相位对比图像铺在I型胶原上,并在分选后培养48小时(放大倍数×100)。在 1 型胶原上培养 48 小时后,用甲胎蛋白(AFP)(绿色)和 CK19(红色)抗体处理的分选的肝细胞的代表性区域的免疫荧光染
参考此文章,可使用 IDLV+特异性启动子+荧光(GFP,RFP等)或者抗性(puromycin、neomycin)进行正向筛选;也可使用 IDLV+特异性启动子+TK 自杀基因进行负向筛选,在不改变细胞株基因组的情况下得到表型一致的细胞群,极大缩短了筛选周期!
IDLV 的实验数据
万能又百搭的 IDLV,真的是如此优秀吗?一起来看一下相关的实验数据:
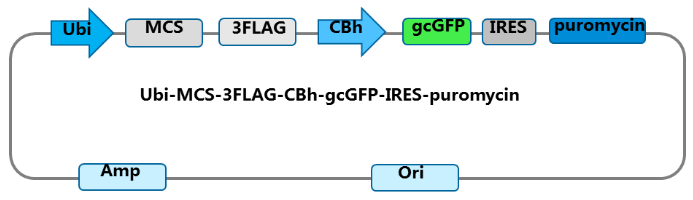
吉凯基因强荧光慢病毒载体骨架
1. 分裂/非分裂细胞表达时间
细胞类型分为增殖细胞及非增殖细胞,利用药物 aphidicolin 诱导 293T 为非增殖细胞。实验结果如下:
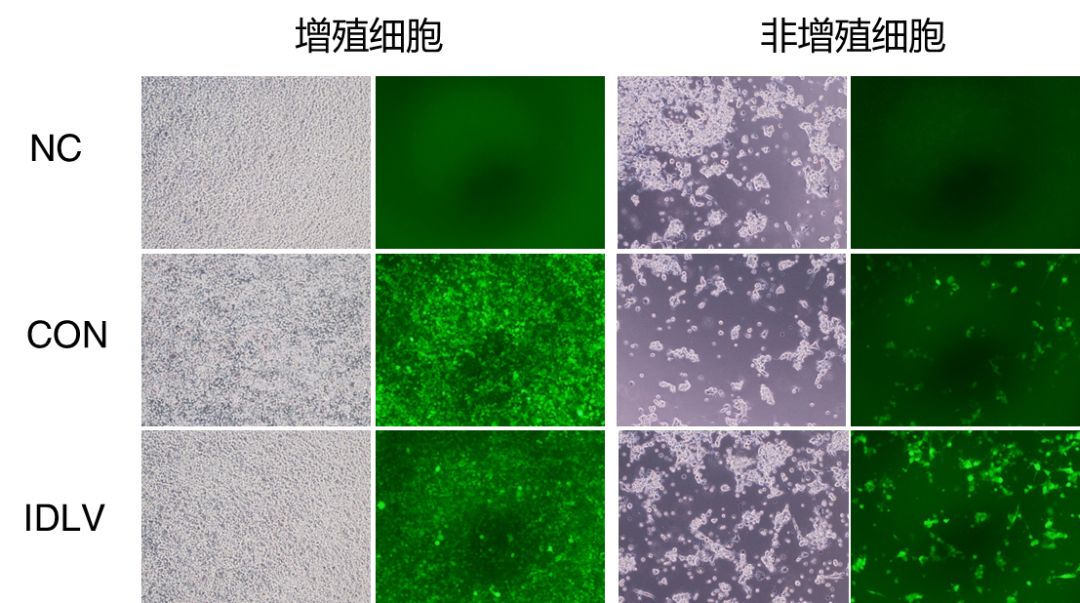
Day3
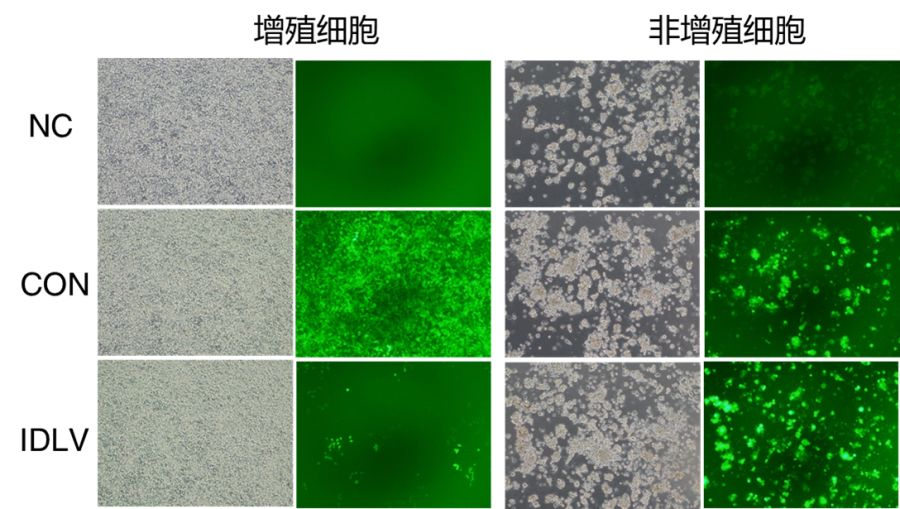
Day8
Day14
数据显示,IDLV 感染非增殖细胞 14 天依然维持稳定表达能力;而感染增殖细胞时,随着细胞的复制以及传代,8-14 日病毒颗粒已丢失殆尽。
2. 非整合特性验证
分别采用 LV、IDLV 感染 293T 细胞,观察感染后 3、6、8 天的病毒基因组相对含量数值的变化(QPCR 检测病毒基因组与内参 actin 的相对值):
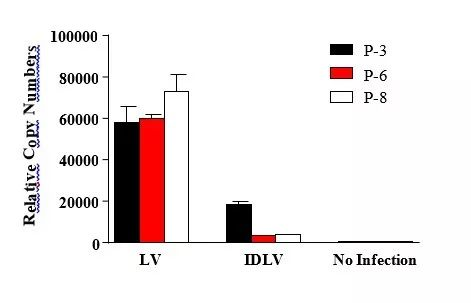
QPCR 检测病毒基因组数据
数据表明,在增殖的 293T 细胞中,LV 基因组稳定存在;而 IDLV 基因组则随着时间的推移而丢失,仅表现出极低的整合特性,整合频率仅仅 0.1-2.3%。
对 IDLV 整合能力、感染能力以及在分裂/非分裂细胞表达稳定性方面开展测试,得到的数据与先前报道的相吻合1,2。
总 结
IDLV 为病毒介导的基因转移提供了新的选择,比起其他传递方法,具有许多优势:
(1)它们能够有效转导广泛的细胞和组织;
(2)它们具有大的包装能力;
(3)它们表现出低的细胞毒性和免疫原性;
(4)它们保持非常弱的整合能力并且从附加型基因组瞬时表达。
当然,IDLV 应用领域不局限于本文列举案例,各位大咖可以打开脑洞,匹配合适的应用场景!
【参考文献】
- Integration-deficient Lentiviral Vectors: A Slow Coming of Age
- Transient Expression of Green Fluorescent Protein in Integrase-Defective Lentiviral Vector-Transduced 293T Cell Line
- Integration-deficient lentivectors: an effective strategy to purify and differentiate human embryonic stem cell-derived hepatic progenitors
- Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing
- Targeted genome editing by lentiviral protein transduction of zinc-finger and TAL-effector nucleases
- Genome Editing Technologies in Drug Development – EMA Expert Meeting provides State of the Art and Outlook