小鼠基因型怎样鉴定更严谨?
集萃药康
小鼠模型提前制作完成啦!距 CNS 又近了一步!心情也好了一些!
可交付的小鼠基因型对不对怎么确认呢?
之前听说过 PCR 鉴定!还听说过 Southern blot 鉴定!还有没有其他鉴定方式?
不同的鉴定方法都有哪些局限性?基因型鉴定都有哪些坑等着自己跳?
一份小鼠基因型鉴定严谨的标准是什么样子的?
看完今天的介绍你就全部明白了!
常用基因型鉴定包括以下几种方法:
一、双臂 PCR 鉴定
双臂 PCR 是基因编辑小鼠模型基因型检测最常用的方法。方法是选取臂外引物与内部引物,以鼠尾基因组 DNA 为模板进行 PCR 扩增,电泳确认 PCR 产物大小,对大小正确的产物进行测序,如测序结果与理论序列一致,则确认该基因编辑小鼠模型为正确重组模型。
TIPS
双臂 PCR 产物需测通:我们在实践中发现,即使 Donor 序列完全正确,部分鼠会存在突变或片段缺失的情况,我们推测是细胞在 Donor 重组前或过程中对 Donor 发生了编辑或重组后结构不稳定等原因所致,所以只对 Donor 各个部分接头测序是不严谨的,建议测通。
下面以 CKO 模型鉴定为例说明双臂 PCR 鉴定方法:
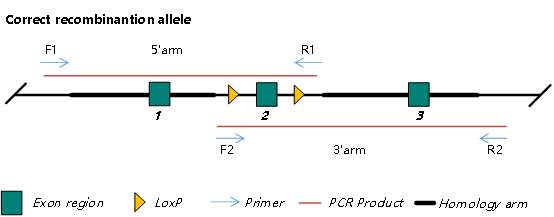
图 1. CKO 正确重组双臂 PCR 鉴定示意图
如图 1 所示,F1 与 R2 为目的位点臂外引物,只有 Donor 正确重组入靶位点,双臂 PCR(5’arm 和 3’arm)才能扩增出预期条带,进而判断模型为正确重组模型。
TIPS
由于 KO(基因敲除)或 TG(转基因)小鼠模型鉴定较为简单,本文只讨论模型制作时带有重组 Donor 的小鼠模型的鉴定方法。
但双臂 PCR 鉴定存在一定的缺陷:
- 无法鉴定模型是否有随机插入。F1 与 R2为目的位点臂外引物,无法鉴定出未在目的位点重组的随机插入,而 Donor 随机插入有可能影响未知基因的功能,对模型造成一定的影响。
- 无法鉴定串联重组。实践中线性 Donor DNA 片段会在细胞中形成头尾相连的串联结构重组到目的位点,PCR 鉴定无法鉴定出此类非预期重组。下图为 CKO 双拷贝串联重组示意图:
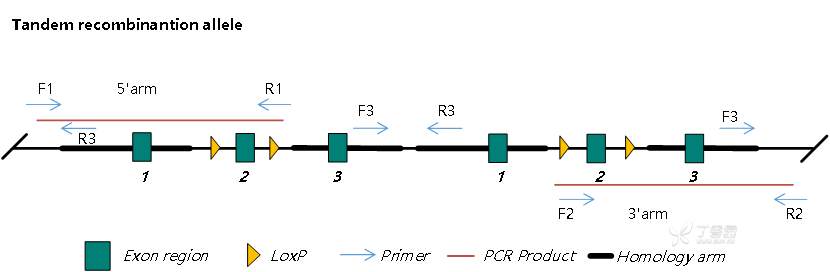
图 2. CKO 双拷贝串联重组双臂 PCR 鉴定示意图
如图 2 所示,串联重组 PCR 鉴定产物大小与测序结果皆与图一正确重组的 PCR 结果一致,所以双臂 PCR 鉴定分辨是正确重组还是串联重组,而 CKO 串联重组会导致 mRNA 剪接异常,在 Cre 前既表现出全身性 KO 的表型。一般来说串联重组比随机插入对模型有影响的概率大得多,所以排除串联重组尤为要重视。可以设计 F3/R3 引物 PCR 进行串联检测,未串联无扩增产物,串联会扩增串联产物,该方法可以排除串联,但无法排除随机插入。
二、Southern blot 鉴定
为了排除模型随机插入和串联重组问题,在双臂 PCR 鉴定正确后,研究者用 Southern blot 做进一步验证。双臂 PCR 加 Southern blot 验证一直作为正确重组的金标准而存在。
Southern blot 判断正确重组原理示意图如下:
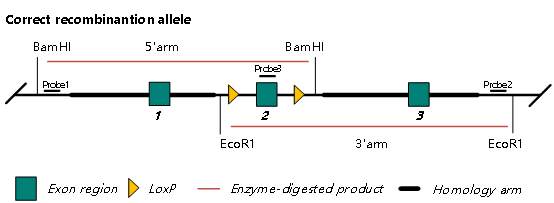
图 3. CKO 正确重组 Southern Blot 鉴定示意图
如图 3 所示,在构建 CKO 重组 Donor 时引入 EcoRI 和 BamHI,引入的位点与臂外对应的酶切位点会切出一条特异性大小的 DNA 条带,通过可以与该条带特异性结合的探针显示该条带是否与预期大小一致,进而判断是否正确重组。如发生随机插入或串联重组,会导致非目标条带的杂带出现,从而排除随机插入或串联重组。Probe3 可检测正确重组,并排除随机插入和串联重组;Probe1 与 Probe2 用于检测重组正确(判定正确重组比 Probe3 更严谨,因为使用 Probe3 随机插入的条带也有概率与重组条带大小一致,而把随机插入条带误判为正确重组条带,导致假阳性。)
Southern Blot 鉴定随机插入原理图如下:
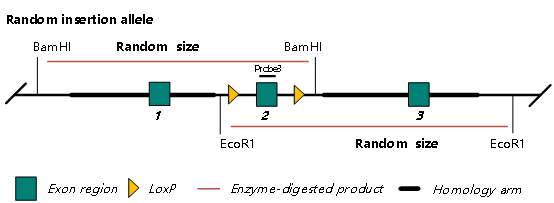
图 4. CKO 随机插入 Southern blot 鉴定示意图
如图 4 所示,如发生随机插入,因为插入位点旁的 BamHI 和 EcoRI 位点距插入位点的距离是随机的,使用 Probe3 探针可检测出一条随机大小的条带。如这条随机大小的条带与重组条带大小有一定的差异,且大小在 Southern Blot 检测范围内,则会检测出一条杂带,从而判断和排除随机插入。
串联重组 Southern Blot 鉴定原理图如下:
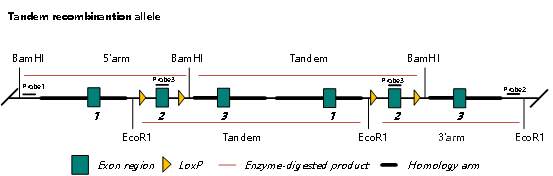
图 5. CKO 双拷贝串联重组 Southern blot 鉴定示意图
如图 5 所示,如发生串联重组,使用 Probe3,可检测出一条 Tandem 杂带,从而判断和排除串联插入(无法区分串联重组还是串联随机插入)。
Southern blot 检测真的是金标准吗?
双臂 PCR 加 Southern blot 验证一直作为正确重组的金标准而存在,但他的含金量足不足呢?其实 Southern blot 在很多情况下有局限性,还存在错检的可能,导致随机插入或串联重组的小鼠被判为正确重组的小鼠。
Southern blot 局限性分析如下:
1、基因组 DNA 酶切后条带大小不在检测范围之内,导致非目的插入的假阴性:
Southern blot 检测较为理想的检测范围为 1-20kb;小于 1kb 条带在低浓度胶中电泳较为弥散,弥赛的条带容易错判;大于 20kb 条带也由于多种原因较难检测,更大的条带还有可能存在滞留胶孔的可能。靶片段不在检测范围会导致假阴性。
导致靶片段大小不在检测范围的具体原因:
1)随机插入位置酶切位点是随机的,所以酶切会产生随机的过大或过小条带。
2)多拷贝串联中产生的比预期条带大的条带,可能会超过检测范围。
3)酶切不充分导致随机插入位置酶切片段太大。
2、随机插入与正确重组条带大小相似:
这时会产生两种错误判断
1)把多条带误判为一条带,因为随机插入产生的随机大小的条带有概率与重组条带大小相同,进而导致随机插入检测假阴性。
2)如果这时随机插入没有同时伴随正确重组,还会产生重组假阳性的风险,用探针 Probe1/2 可以避免假阳性,但部分模型定制服务商只采用 Probe3,所以在接受模型服务商提供的鉴定报告时注意判断所用探针位置。
3、Southern blot 探针至少需 300-500bp,对于使用小于该长度的 Donor 的小鼠模型无法进行检测
4、F0 代检测结果不能代替 F1 代鉴定结果:
有的小鼠模型鉴定报告,用 F0 代小鼠的 Southern 鉴定结果代替 F1 代鉴定结果,这种直接代替是不严谨的。
1)受精卵注射 CRISPR/Cas9 系统制作的品系,F0 代为嵌合鼠。如果非预期插入嵌合率较低,会导致靶 DNA 低于检测阈值;
2)另外检测一般检测鼠尾,而鼠尾与生殖系统嵌合率并不一定一致,所以以 F0 鼠尾的 Southern 检测代替生殖系统的检测是存在错检的风险的(包括假阳性和假阴性)。所以对 F1 代小鼠进行 Southern 检测会更严谨一些。
三、qPCR 鉴定
因为 Southern blot 检测这些局限性,集萃药康一直较为慎用 Southern blot 检测结果作为检测的金标准。
集萃药康作为世界小鼠模型制作的引领者之一,一直在积极探索更为严谨的检测随机插入与串联重组的标准。
qPCR (Quantitative Realtime-PCR) 技术常用于基因拷贝数定量分析。该方法可以用于检测模型小鼠 Donor 插入拷贝数,如发生随机插入或串联重组,Donor 的拷贝数会大于 1,从而排除这两种非预期插入。
综上所述,集萃药康建议对新制作的小鼠模型通过跨臂 PCR 大小证明重组位置正确,通过测通保证重组序列无突变,通过 qPCR 确认基因组单拷贝排除随机插入与串联重组,通过串联检测进一步排除串联的存在尤其是串联重组,4 个证据检测正确的小鼠结果更为严谨。