Cell Rep:梁洪青 / 刘琬璐 / 张丹等团队揭秘 ERV 不同亚家族在人类早期胚胎中的特异性调控机制和功能
丁香学术
转座子(Transposable elements, TEs)是一类可以在基因组移动的 DNA 序列,是人类基因组的重要组成部分(占比接近 43%), 分为 DNA 转座子和逆转座子。
内源性逆转录病毒(ERV)是逆转座子的一个主要分支,可能是进化过程中逆转录病毒感染宿主并整合至宿主基因组的产物,ERV 在哺乳动物基因组中大量扩增,虽然目前大都失去了转座能力,但其残留在基因组中的序列仍以不同方式影响着基因组的结构和基因的表达。与其他逆转座子相比,ERVs 的序列具有更多的复杂性和较小的重复性,从而使其在基因组中发挥特异性更强、独立性更高的转录调控功能。
根据 DNA 序列的差异 ERV 又分为不同的亚家族,它们与哺乳动物的配子形成、早期胚胎发育、免疫疾病、神经系统疾病和肿瘤发生等具有高度相关性,可能广泛参与发育和病理条件下的转录调控过程。然而目前针对 ERV 不同亚家族的特异性调控机制,及其对细胞状态和功能的影响,相关的研究还非常有限。以往的研究表明,大多 ERV 在早期胚胎发育过程中高度激活,并且不同 ERV 在胚胎发育的不同阶段具有特异性的表达。越来越多的证据提示 ERV 可能参与早期胚胎发育的转录调控,其具体的调控机制和功能仍然有待研究。
2022 年 8 月 23 日,浙江大学医学院梁洪青课题组、张丹课题组、浙大爱丁堡大学联合学院刘琬璐课题组、以及广东省实验室 Yun-Shen Chan 课题组联合在 Cell Reports 上发表题为 Krüppel-like factor 5 rewires NANOG regulatory network to activate human naïve pluripotency specific LTR7Ys and promote naïve pluripotency 的长文,揭示了人类胚胎植入前后分别活跃表达的 LTR7Y 和 LTR7,作为 HERVH 亚家族的两个不同 LTR 元件,是如何分别被 naïve 和 primed 转录调控网络特异性激活,并调节不同多能性状态干细胞的发育潜能。

人类早期胚胎的单细胞转录组分析数据显示,在不同胚胎发育阶段,ERV 不同亚家族成员具有胚胎阶段特异性的激活(1)。其中在植入前和植入后囊胚,以及分别对应的 naïve 和 primed 多能性干细胞中,LTR7Y 和 LTR7 分别被激活。该研究通过筛选,鉴定了 KLFs 家族的 KLF4/KLF5 可以特异性激活基因组中的 LTR7Y 拷贝,但并不能激活 LTR7 相关拷贝。该研究进一步对 naïve hESCs 进行了单细胞测序,从单细胞水平分析了 KLFs 家族与多能性相关的 TEs 之间的相关性。结果表明,与其他 KLFs-TEs 相比,KLF4/KLF5 与 LTR7Y 的相关性最高,而与 LTR7 的相关性较弱。
随后,该研究利用 KLF4/KLF5 敲除细胞系的 RNA-seq 技术发现,naïve hESCs 中同时敲除 KLF4/KLF5,下降最明显的 TE 是 LTR7Y,但却伴随着 LTR7 的表达上调。此外该研究发现 NANOG 可协同 KLF5,并增强 KLF5 对 LTR7Y 的激活作用,但 NANOG 与 KLF4 的协同作用却很微弱。
研究人员进一步联合运用 RNA-seq、ChIP-seq、CUT&Tag 以及 ATAC-seq 等多组学技术,发现 LTR7Y 和 LTR7 的序列虽然高度保守,但其中具有 KLF5 保守结合位点的差异;这使得 LTR7Y 可以被 KLF5 和 NANOG 共同结合,而 LTR7 只能被 NANOG 结合(图一)。进一步的实验证明,在 primed 向 naïve 多能性转变的过程中,KLF5 可以重塑 NANOG 的结合偏好性,将其从 primed 特异的 LTR7 位点上,转移至 naïve 特异的 LTR7Y 位点上。在这一过程中,KLF5 发挥了先驱因子的作用,通过增强 LTR7Y 区域的染色质开放性,招募 NANOG 及 P300 在 LTR7Y 上结合,从而在 naïve 状态激活 LTR7Y。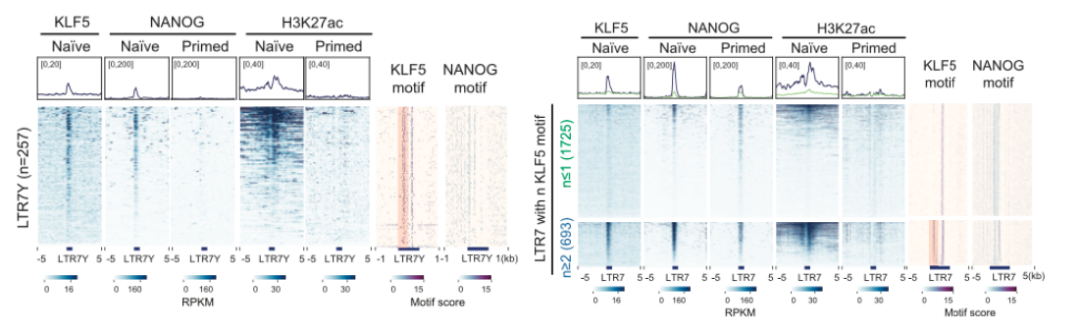
图1 KLF5 重塑 NANOG 转录网络,促进 naïve 多能性
更有意思的是,naïve 多能性状态下 KLF5 对于 LTR7Y 的激活可以增强 LTR7Y 周围 naïve 多能性基因的表达。这些基因中包含了滋养外胚层的关键转录调控因子。研究进一步通过 CRISPR 激活和抑制实验证明,对 LTR7Y 位点的操纵可以影响部分 KLF5 下游滋养外胚层相关基因的表达。同时 CRISPRa 对 LTR7Y 的激活也可以加速胚胎干细胞向滋养外胚层的分化(图 2)。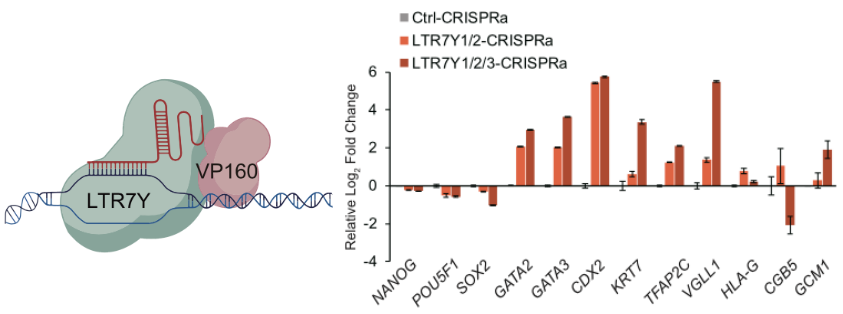
图2 CRISPRa 系统激活 LTR7Y,促进 hESCs 向滋养外胚层细胞分化
综上,本研究以植入前和植入后囊胚分别开启的 LTR7Y 和 LTR7 为对象,深入研究并发现了 KLF5 与 NANOG 协同并特异性激活 LTR7Y 顺式调控功能,从而促进人类 naïve 多能性,并拓展了胚胎干细胞向滋养外胚层细胞分化的潜能(图 3)。这不仅对于理解不同 ERV 亚家族在人类早期胚胎发育中特异性调控功能具有重要意义,也提示了从 ERV 角度理解人类滋养外胚层功能与胚胎植入失败等临床问题的新研究视角。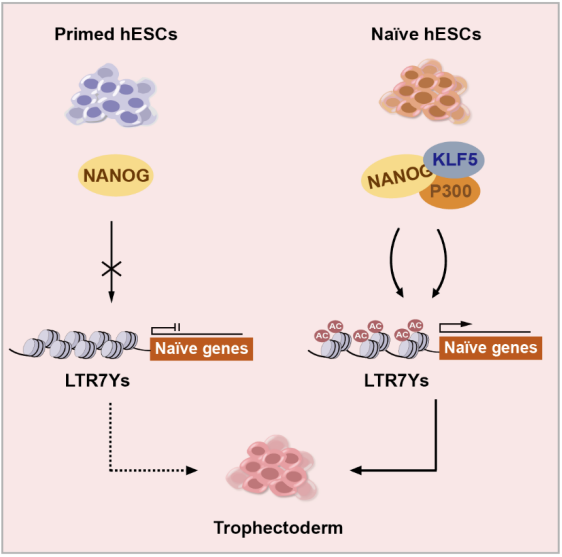
图3 本研究的机制示意图