Neuron:北大陈雷研究组报道胞内钙离子对 TRPC3/6 通道调控的机制
丁香学术
329
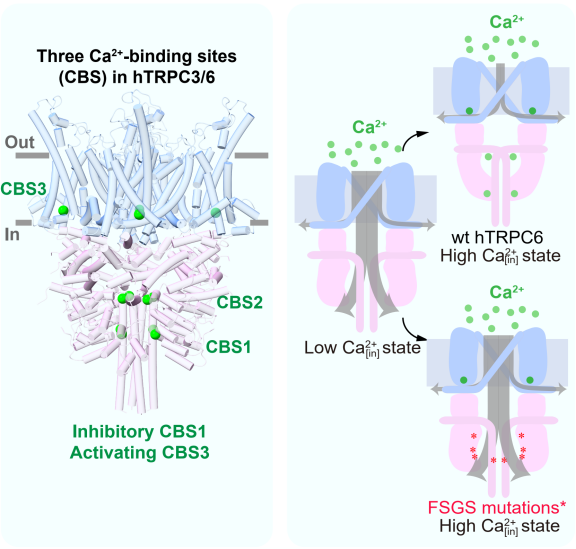
图 1 Ca2+ 通过 CBS1-3 对 TRPC3/6 及 FSGS 相关突变体的调控模式图
丁香学术

图 1 Ca2+ 通过 CBS1-3 对 TRPC3/6 及 FSGS 相关突变体的调控模式图
相关产品推荐

IDO1 抑制剂作用机制检测试剂盒-IDO1 Inhibitor Mechanism of Action Assay Kit
¥12

KCP/KCP蛋白Recombinant Human Kielin/chordin-like protein (KCP)重组蛋白Cysteine-rich BMP regulator 2 Cysteine-rich motor neuron 2 protein Kielin/chordin-like protein 1蛋白
¥2328

anti-TRPC3
¥1180

醋酸二己铵溶液,366793-17-1,0.5M in H₂O,适用于离子对色谱, ChromaClear™,阿拉丁
¥199.90

TRAM-34,K Ca 3.1通道阻滞剂,289905-88-0,Moligand™, ≥98%,阿拉丁
¥350.90

