免疫共沉淀实验方法
互联网
免疫共沉淀(co-immunoprecipitation)是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。 其原理是:当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。如果用蛋白质x的抗体免疫沉淀x,那么与x在体内结合的蛋白质y也能沉淀下来。这种方法常用于测定两种目标蛋白质是否在体内结合;也可用于确定一种特定蛋白质的新的作用搭档。
其优点为:(1)相互作用的蛋白质都是经翻译后修饰的,处于天然状态;(2)蛋白的相互作用是在自然状态下进行的,可以避免人为的影响;(3)可以分离得到天然状态的相互作用蛋白复合物。缺点为:(1)可能检测不到低亲和力和瞬间的蛋白质-蛋白质相互作用;(2)两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用; (3)必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。
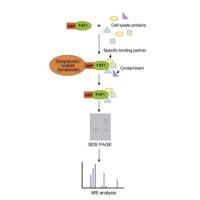
实验流程为:
(1)转染后24-48 h 可收获细胞,加入适量细胞裂解缓冲液(含蛋白酶抑制剂),冰上裂解30min, 细胞裂解液于4°c, 最大转速离心30 min后取上清;
(2)取少量裂解液以备western blot分析,剩余裂解液加1μg相应的抗体加入到细胞裂解液,4°c缓慢摇晃孵育过夜;
(3)取10μl protein a 琼脂糖珠,用适量裂解缓冲液洗3 次,每次3,000 rpm离心3 min;
(4)将预处理过的10μl protein a 琼脂糖珠加入到和抗体孵育过夜的细胞裂解液中4°c缓慢摇晃孵育2-4h,使抗体与protein a琼脂糖珠偶连;
(5)免疫沉淀反应后,在4°c 以3,000 rpm 速度离心3 min,将琼脂糖珠离心至管底;将上清小心吸去,琼脂糖珠用1ml裂解缓冲液洗3-4次;最后加入15μl的2×sds 上样缓冲液,沸水煮5分钟;
(6)sds-page, western blotting或质谱仪分析。
注意的问题:
(1)细胞裂解采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质-蛋白质相互作用,多采用非离子变性剂(np40或triton x-100)。每种细胞的裂解条件是不一样的,通过经验确定。不能用高浓度的变性剂(0.2%sds),细胞裂解液中要加各种酶抑制剂,如商品化的cocktailer。
(2)使用明确的抗体,可以将几种抗体共同使用
(3)使用对照抗体:
单克隆抗体:正常小鼠的igg或另一类单抗
兔多克隆抗体:正常兔igg
在免疫共沉淀实验中要保证实验结果的真实性,应注意以下几点:
(1) 确保共沉淀的蛋白是由所加入的抗体沉淀得到的,而并非外源非特异蛋白,单克隆抗体的使用有助于避免污染的发生;
(2) 要确保抗体的特异性,即在不表达抗原的细胞溶解物中添加抗体后不会引起共沉淀;
(3) 确定蛋白间的相互作用是发生在细胞中,而不是由于细胞的溶解才发生的,这需要进行蛋白质的定位来确定。