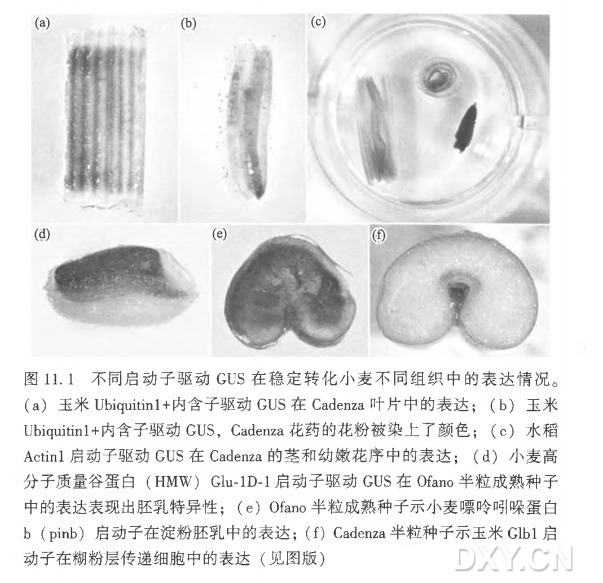
与DNA结合蛋白相作用的启动子序列的鉴定
互联网
2046
迁移率变动分析法
l 聚丙烯酰胺凝胶的制备
1. 组装电泳装置并洗净玻璃板。
2. 按下表配制 4 %非变性丙稀酰按凝胶溶液:
丙稀酰按 / 双丙稀酰按( 29 : 1 ) 4ml
TBE ( 10 ×) 3ml
APS ( 10 %) 200 μ l
TEMED 40 μ l
可灌制成 1 ~ 1.5mm 厚的凝胶。凝胶聚合约需 1 小时,使用前可于室温下保存 1 天。
l DNA -蛋白质结合反应
1. 将 10mg/ml 的 poly(dI-dC) • poly(dI-dC) 贮液用无菌双蒸馏水稀释成终浓度 6 μ g/ μ l 。将 6 μ g/ μ l 的 poly(dI-dC) • poly(dI-dC) 溶液与 32mmol/L ( pH8.0 )的 EDTA 等体积混合,配制成工作溶液。用片段重悬缓冲液将 32 P 标记的 DNA 片段稀释至终浓度 2fmol/ μ l 。
2. 对于标准 DNA- 蛋白质结合反应,按下表顺序将下列试剂加入 1.5ml 微量离心管:
32 P- 标记 DNA 片段( 2fmol/ μ l ) 0.5 μ l
poly(dI-dC) • poly(dI-dC) + EDTA 工作溶液 0.5 μ l
核抽提液和 / 或透析缓冲液 9 μ l
总体积 10 μ l
吹吸混匀。
3. 室温温育 45 分钟,此时可将凝胶在 100V 预电泳 10 ~ 15 分钟。
4. 温育结束后,可不加染液直接将样品加在凝胶上。在一个小样孔中单独加入 10 μ l 含 0.05 %二甲苯青和 0.05 %溴酚蓝的透析缓冲液用来跟踪电泳进程。
5. 用 1 × TBE 缓冲液在约 10V/cm 条件下电泳约 2 小时。具体时间取决于所使用的 DNA 片段的大小。
6. 小心地把凝胶转移到 Whatman 3MM 滤纸上并用保鲜膜覆盖在凝胶上。 80 ℃用凝胶干燥器干燥凝胶约 1 小时。
7. 室温下把干燥凝胶对 X 光片曝光过夜。
l 聚丙烯酰胺凝胶的制备
1. 组装电泳装置并洗净玻璃板。
2. 按下表配制 4 %非变性丙稀酰按凝胶溶液:
丙稀酰按 / 双丙稀酰按( 29 : 1 ) 4ml
TBE ( 10 ×) 3ml
APS ( 10 %) 200 μ l
TEMED 40 μ l
可灌制成 1 ~ 1.5mm 厚的凝胶。凝胶聚合约需 1 小时,使用前可于室温下保存 1 天。
l DNA -蛋白质结合反应
1. 将 10mg/ml 的 poly(dI-dC) • poly(dI-dC) 贮液用无菌双蒸馏水稀释成终浓度 6 μ g/ μ l 。将 6 μ g/ μ l 的 poly(dI-dC) • poly(dI-dC) 溶液与 32mmol/L ( pH8.0 )的 EDTA 等体积混合,配制成工作溶液。用片段重悬缓冲液将 32 P 标记的 DNA 片段稀释至终浓度 2fmol/ μ l 。
2. 对于标准 DNA- 蛋白质结合反应,按下表顺序将下列试剂加入 1.5ml 微量离心管:
32 P- 标记 DNA 片段( 2fmol/ μ l ) 0.5 μ l
poly(dI-dC) • poly(dI-dC) + EDTA 工作溶液 0.5 μ l
核抽提液和 / 或透析缓冲液 9 μ l
总体积 10 μ l
吹吸混匀。
3. 室温温育 45 分钟,此时可将凝胶在 100V 预电泳 10 ~ 15 分钟。
4. 温育结束后,可不加染液直接将样品加在凝胶上。在一个小样孔中单独加入 10 μ l 含 0.05 %二甲苯青和 0.05 %溴酚蓝的透析缓冲液用来跟踪电泳进程。
5. 用 1 × TBE 缓冲液在约 10V/cm 条件下电泳约 2 小时。具体时间取决于所使用的 DNA 片段的大小。
6. 小心地把凝胶转移到 Whatman 3MM 滤纸上并用保鲜膜覆盖在凝胶上。 80 ℃用凝胶干燥器干燥凝胶约 1 小时。
7. 室温下把干燥凝胶对 X 光片曝光过夜。
DNase I 足迹分析法
l 聚丙烯酰胺凝胶的制备
1. 组装制作测序胶所需装置并洗净玻璃板。
2. 按下表配制 4 %非变性丙稀酰按凝胶溶液:
丙稀酰按 / 双丙稀酰按( 38 : 2 ) 11.3ml
尿素 31.5g
TBE ( 10 ×) 3.75ml
APS ( 10 %) 300 μ l
TEMED 30 μ l
灌制凝胶。此凝胶聚合约需 2 小时。使用前可在室温下存放 1 天。
l DNA -蛋白质结合反应
1. 将 10mg/ml 的 poly(dI-dC) • poly(dI-dC) 贮液用水稀释成 6 μ g/ μ l ,等体积混合 6 μ g/ μ l poly(dI-dC) • poly(dI-dC) 和 32mmol/L EDTA ( pH8.0 ),配制成 poly(dI-dC) + EDTA 工作溶液。将 32 P 标记的 DNA 片段用片段重悬缓冲液稀释成 2fmol/ μ l 。
2. 对于标准结合反应,将以下试剂按下表顺序逐个加入 1.5ml 微量离心管:
32 P 标记 DNA 片段( 2fmol ;通常约 20 000cpm ) 1 μ l
poly(dI-dC) • poly(dI-dC) + EDTA 工作溶液 1 μ l
核抽提液和 / 或透析缓冲液 18 μ l
(含 20 ~ 50 μ g 蛋白质,具体用量取决于抽提物中 DNA 结合蛋白的活性)
总体积 20 μ l
吹吸混匀。
3. 室温温育 30 分钟。温育过程中,用 DNase I 稀释缓冲液稀释 DNase I 。(对于标准结合反应,稀释后的 DNase I 的浓度为 20 μ g/ml )
4. 每管结合反应混合液中加 2 μ l 稀释的 DNase I 溶液,吹吸混匀(标准结合反应中, DNase I 的终浓度为 2 μ g/ml )。室温温育 10 分钟,从第一次加样入结合反应混合液终起开始计时。
5. 加入 80 μ l DNase I 终止液和 100 μ l 酚 / 氯仿 / 异戊醇( 25 : 24 : 1 )以终止酶解反应。
6. 振荡每管样品数秒,注意微量离心管管口应旋紧。室温离心 3 ~ 5 分钟。
7. 每管移取 85 μ l 上层水相至另一新管,将含酚相的离心管作为放射性废弃物丢弃。向每管水相中加入 200 μ l 95 %乙醇,略作振荡后,将管置于碎干冰上放置 15 ~ 20 分钟。
8. 离心 20 分钟,小心弃上清。向每管沉淀加入 500 μ l 85 %乙醇。离心 2 ~ 3 分钟,小心弃去上清,干燥沉淀。
9. 将沉淀在真空离心蒸发浓缩器中干燥约 5 分钟(确保沉淀干燥彻底)。每管中加入 3 μ l 甲酰按染液,用 Eppendorf 振荡器或涡旋混匀。
10. 煮样品 3 分钟后,立即置于冰上冷却。稍作离心,使样品汇集于管底,再放回冰上。上样于 6 %测序胶,然后用 1 ×测序 TBE 缓冲液,在 45 ~ 50 ℃ 3000~4000V 下电泳,直至溴酚蓝走到凝胶底部。电泳过程中,为保持凝胶温度在 45 ~ 50 ℃ ,可能需要加大电压。
11. 甲醇 / 乙酸 /H2 O ( 5 : 5 : 90 )固定凝胶 15 分钟后,将胶移至 Whatman 3MM 滤纸上用凝胶干燥器干燥。
12. 把干燥凝胶对 X 光片在- 80 ℃曝光过夜,需使用增感屏。
l 聚丙烯酰胺凝胶的制备
1. 组装制作测序胶所需装置并洗净玻璃板。
2. 按下表配制 4 %非变性丙稀酰按凝胶溶液:
丙稀酰按 / 双丙稀酰按( 38 : 2 ) 11.3ml
尿素 31.5g
TBE ( 10 ×) 3.75ml
APS ( 10 %) 300 μ l
TEMED 30 μ l
灌制凝胶。此凝胶聚合约需 2 小时。使用前可在室温下存放 1 天。
l DNA -蛋白质结合反应
1. 将 10mg/ml 的 poly(dI-dC) • poly(dI-dC) 贮液用水稀释成 6 μ g/ μ l ,等体积混合 6 μ g/ μ l poly(dI-dC) • poly(dI-dC) 和 32mmol/L EDTA ( pH8.0 ),配制成 poly(dI-dC) + EDTA 工作溶液。将 32 P 标记的 DNA 片段用片段重悬缓冲液稀释成 2fmol/ μ l 。
2. 对于标准结合反应,将以下试剂按下表顺序逐个加入 1.5ml 微量离心管:
32 P 标记 DNA 片段( 2fmol ;通常约 20 000cpm ) 1 μ l
poly(dI-dC) • poly(dI-dC) + EDTA 工作溶液 1 μ l
核抽提液和 / 或透析缓冲液 18 μ l
(含 20 ~ 50 μ g 蛋白质,具体用量取决于抽提物中 DNA 结合蛋白的活性)
总体积 20 μ l
吹吸混匀。
3. 室温温育 30 分钟。温育过程中,用 DNase I 稀释缓冲液稀释 DNase I 。(对于标准结合反应,稀释后的 DNase I 的浓度为 20 μ g/ml )
4. 每管结合反应混合液中加 2 μ l 稀释的 DNase I 溶液,吹吸混匀(标准结合反应中, DNase I 的终浓度为 2 μ g/ml )。室温温育 10 分钟,从第一次加样入结合反应混合液终起开始计时。
5. 加入 80 μ l DNase I 终止液和 100 μ l 酚 / 氯仿 / 异戊醇( 25 : 24 : 1 )以终止酶解反应。
6. 振荡每管样品数秒,注意微量离心管管口应旋紧。室温离心 3 ~ 5 分钟。
7. 每管移取 85 μ l 上层水相至另一新管,将含酚相的离心管作为放射性废弃物丢弃。向每管水相中加入 200 μ l 95 %乙醇,略作振荡后,将管置于碎干冰上放置 15 ~ 20 分钟。
8. 离心 20 分钟,小心弃上清。向每管沉淀加入 500 μ l 85 %乙醇。离心 2 ~ 3 分钟,小心弃去上清,干燥沉淀。
9. 将沉淀在真空离心蒸发浓缩器中干燥约 5 分钟(确保沉淀干燥彻底)。每管中加入 3 μ l 甲酰按染液,用 Eppendorf 振荡器或涡旋混匀。
10. 煮样品 3 分钟后,立即置于冰上冷却。稍作离心,使样品汇集于管底,再放回冰上。上样于 6 %测序胶,然后用 1 ×测序 TBE 缓冲液,在 45 ~ 50 ℃ 3000~4000V 下电泳,直至溴酚蓝走到凝胶底部。电泳过程中,为保持凝胶温度在 45 ~ 50 ℃ ,可能需要加大电压。
11. 甲醇 / 乙酸 /H2 O ( 5 : 5 : 90 )固定凝胶 15 分钟后,将胶移至 Whatman 3MM 滤纸上用凝胶干燥器干燥。
12. 把干燥凝胶对 X 光片在- 80 ℃曝光过夜,需使用增感屏。
迁移率变动分析法
l 聚丙烯酰胺凝胶的制备
1. 组装电泳装置并洗净玻璃板。
2. 按下表配制 4 %非变性丙稀酰按凝胶溶液:
丙稀酰按 / 双丙稀酰按( 29 : 1 ) 4ml
TBE ( 10 ×) 3ml
APS ( 10 %) 200 μ l
TEMED 40 μ l
可灌制成 1 ~ 1.5mm 厚的凝胶。凝胶聚合约需 1 小时,使用前可于室温下保存 1 天。
l DNA -蛋白质结合反应
1. 将 10mg/ml 的 poly(dI-dC) • poly(dI-dC) 贮液用无菌双蒸馏水稀释成终浓度 6 μ g/ μ l 。将 6 μ g/ μ l 的 poly(dI-dC) • poly(dI-dC) 溶液与 32mmol/L ( pH8.0 )的 EDTA 等体积混合,配制成工作溶液。用片段重悬缓冲液将 32 P 标记的 DNA 片段稀释至终浓度 2fmol/ μ l 。
2. 对于标准 DNA- 蛋白质结合反应,按下表顺序将下列试剂加入 1.5ml 微量离心管:
32 P- 标记 DNA 片段( 2fmol/ μ l ) 0.5 μ l
poly(dI-dC) • poly(dI-dC) + EDTA 工作溶液 0.5 μ l
核抽提液和 / 或透析缓冲液 9 μ l
总体积 10 μ l
吹吸混匀。
3. 室温温育 45 分钟,此时可将凝胶在 100V 预电泳 10 ~ 15 分钟。
4. 温育结束后,可不加染液直接将样品加在凝胶上。在一个小样孔中单独加入 10 μ l 含 0.05 %二甲苯青和 0.05 %溴酚蓝的透析缓冲液用来跟踪电泳进程。
5. 用 1 × TBE 缓冲液在约 10V/cm 条件下电泳约 2 小时。具体时间取决于所使用的 DNA 片段的大小。
6. 小心地把凝胶转移到 Whatman 3MM 滤纸上并用保鲜膜覆盖在凝胶上。 80 ℃用凝胶干燥器干燥凝胶约 1 小时。
7. 室温下把干燥凝胶对 X 光片曝光过夜。
l 聚丙烯酰胺凝胶的制备
1. 组装电泳装置并洗净玻璃板。
2. 按下表配制 4 %非变性丙稀酰按凝胶溶液:
丙稀酰按 / 双丙稀酰按( 29 : 1 ) 4ml
TBE ( 10 ×) 3ml
APS ( 10 %) 200 μ l
TEMED 40 μ l
可灌制成 1 ~ 1.5mm 厚的凝胶。凝胶聚合约需 1 小时,使用前可于室温下保存 1 天。
l DNA -蛋白质结合反应
1. 将 10mg/ml 的 poly(dI-dC) • poly(dI-dC) 贮液用无菌双蒸馏水稀释成终浓度 6 μ g/ μ l 。将 6 μ g/ μ l 的 poly(dI-dC) • poly(dI-dC) 溶液与 32mmol/L ( pH8.0 )的 EDTA 等体积混合,配制成工作溶液。用片段重悬缓冲液将 32 P 标记的 DNA 片段稀释至终浓度 2fmol/ μ l 。
2. 对于标准 DNA- 蛋白质结合反应,按下表顺序将下列试剂加入 1.5ml 微量离心管:
32 P- 标记 DNA 片段( 2fmol/ μ l ) 0.5 μ l
poly(dI-dC) • poly(dI-dC) + EDTA 工作溶液 0.5 μ l
核抽提液和 / 或透析缓冲液 9 μ l
总体积 10 μ l
吹吸混匀。
3. 室温温育 45 分钟,此时可将凝胶在 100V 预电泳 10 ~ 15 分钟。
4. 温育结束后,可不加染液直接将样品加在凝胶上。在一个小样孔中单独加入 10 μ l 含 0.05 %二甲苯青和 0.05 %溴酚蓝的透析缓冲液用来跟踪电泳进程。
5. 用 1 × TBE 缓冲液在约 10V/cm 条件下电泳约 2 小时。具体时间取决于所使用的 DNA 片段的大小。
6. 小心地把凝胶转移到 Whatman 3MM 滤纸上并用保鲜膜覆盖在凝胶上。 80 ℃用凝胶干燥器干燥凝胶约 1 小时。
7. 室温下把干燥凝胶对 X 光片曝光过夜。
DNase I 足迹分析法
l 聚丙烯酰胺凝胶的制备
1. 组装制作测序胶所需装置并洗净玻璃板。
2. 按下表配制 4 %非变性丙稀酰按凝胶溶液:
丙稀酰按 / 双丙稀酰按( 38 : 2 ) 11.3ml
尿素 31.5g
TBE ( 10 ×) 3.75ml
APS ( 10 %) 300 μ l
TEMED 30 μ l
灌制凝胶。此凝胶聚合约需 2 小时。使用前可在室温下存放 1 天。
l DNA -蛋白质结合反应
1. 将 10mg/ml 的 poly(dI-dC) • poly(dI-dC) 贮液用水稀释成 6 μ g/ μ l ,等体积混合 6 μ g/ μ l poly(dI-dC) • poly(dI-dC) 和 32mmol/L EDTA ( pH8.0 ),配制成 poly(dI-dC) + EDTA 工作溶液。将 32 P 标记的 DNA 片段用片段重悬缓冲液稀释成 2fmol/ μ l 。
2. 对于标准结合反应,将以下试剂按下表顺序逐个加入 1.5ml 微量离心管:
32 P 标记 DNA 片段( 2fmol ;通常约 20 000cpm ) 1 μ l
poly(dI-dC) • poly(dI-dC) + EDTA 工作溶液 1 μ l
核抽提液和 / 或透析缓冲液 18 μ l
(含 20 ~ 50 μ g 蛋白质,具体用量取决于抽提物中 DNA 结合蛋白的活性)
总体积 20 μ l
吹吸混匀。
3. 室温温育 30 分钟。温育过程中,用 DNase I 稀释缓冲液稀释 DNase I 。(对于标准结合反应,稀释后的 DNase I 的浓度为 20 μ g/ml )
4. 每管结合反应混合液中加 2 μ l 稀释的 DNase I 溶液,吹吸混匀(标准结合反应中, DNase I 的终浓度为 2 μ g/ml )。室温温育 10 分钟,从第一次加样入结合反应混合液终起开始计时。
5. 加入 80 μ l DNase I 终止液和 100 μ l 酚 / 氯仿 / 异戊醇( 25 : 24 : 1 )以终止酶解反应。
6. 振荡每管样品数秒,注意微量离心管管口应旋紧。室温离心 3 ~ 5 分钟。
7. 每管移取 85 μ l 上层水相至另一新管,将含酚相的离心管作为放射性废弃物丢弃。向每管水相中加入 200 μ l 95 %乙醇,略作振荡后,将管置于碎干冰上放置 15 ~ 20 分钟。
8. 离心 20 分钟,小心弃上清。向每管沉淀加入 500 μ l 85 %乙醇。离心 2 ~ 3 分钟,小心弃去上清,干燥沉淀。
9. 将沉淀在真空离心蒸发浓缩器中干燥约 5 分钟(确保沉淀干燥彻底)。每管中加入 3 μ l 甲酰按染液,用 Eppendorf 振荡器或涡旋混匀。
10. 煮样品 3 分钟后,立即置于冰上冷却。稍作离心,使样品汇集于管底,再放回冰上。上样于 6 %测序胶,然后用 1 ×测序 TBE 缓冲液,在 45 ~ 50 ℃ 3000~4000V 下电泳,直至溴酚蓝走到凝胶底部。电泳过程中,为保持凝胶温度在 45 ~ 50 ℃ ,可能需要加大电压。
11. 甲醇 / 乙酸 /H2 O ( 5 : 5 : 90 )固定凝胶 15 分钟后,将胶移至 Whatman 3MM 滤纸上用凝胶干燥器干燥。
12. 把干燥凝胶对 X 光片在- 80 ℃曝光过夜,需使用增感屏。
l 聚丙烯酰胺凝胶的制备
1. 组装制作测序胶所需装置并洗净玻璃板。
2. 按下表配制 4 %非变性丙稀酰按凝胶溶液:
丙稀酰按 / 双丙稀酰按( 38 : 2 ) 11.3ml
尿素 31.5g
TBE ( 10 ×) 3.75ml
APS ( 10 %) 300 μ l
TEMED 30 μ l
灌制凝胶。此凝胶聚合约需 2 小时。使用前可在室温下存放 1 天。
l DNA -蛋白质结合反应
1. 将 10mg/ml 的 poly(dI-dC) • poly(dI-dC) 贮液用水稀释成 6 μ g/ μ l ,等体积混合 6 μ g/ μ l poly(dI-dC) • poly(dI-dC) 和 32mmol/L EDTA ( pH8.0 ),配制成 poly(dI-dC) + EDTA 工作溶液。将 32 P 标记的 DNA 片段用片段重悬缓冲液稀释成 2fmol/ μ l 。
2. 对于标准结合反应,将以下试剂按下表顺序逐个加入 1.5ml 微量离心管:
32 P 标记 DNA 片段( 2fmol ;通常约 20 000cpm ) 1 μ l
poly(dI-dC) • poly(dI-dC) + EDTA 工作溶液 1 μ l
核抽提液和 / 或透析缓冲液 18 μ l
(含 20 ~ 50 μ g 蛋白质,具体用量取决于抽提物中 DNA 结合蛋白的活性)
总体积 20 μ l
吹吸混匀。
3. 室温温育 30 分钟。温育过程中,用 DNase I 稀释缓冲液稀释 DNase I 。(对于标准结合反应,稀释后的 DNase I 的浓度为 20 μ g/ml )
4. 每管结合反应混合液中加 2 μ l 稀释的 DNase I 溶液,吹吸混匀(标准结合反应中, DNase I 的终浓度为 2 μ g/ml )。室温温育 10 分钟,从第一次加样入结合反应混合液终起开始计时。
5. 加入 80 μ l DNase I 终止液和 100 μ l 酚 / 氯仿 / 异戊醇( 25 : 24 : 1 )以终止酶解反应。
6. 振荡每管样品数秒,注意微量离心管管口应旋紧。室温离心 3 ~ 5 分钟。
7. 每管移取 85 μ l 上层水相至另一新管,将含酚相的离心管作为放射性废弃物丢弃。向每管水相中加入 200 μ l 95 %乙醇,略作振荡后,将管置于碎干冰上放置 15 ~ 20 分钟。
8. 离心 20 分钟,小心弃上清。向每管沉淀加入 500 μ l 85 %乙醇。离心 2 ~ 3 分钟,小心弃去上清,干燥沉淀。
9. 将沉淀在真空离心蒸发浓缩器中干燥约 5 分钟(确保沉淀干燥彻底)。每管中加入 3 μ l 甲酰按染液,用 Eppendorf 振荡器或涡旋混匀。
10. 煮样品 3 分钟后,立即置于冰上冷却。稍作离心,使样品汇集于管底,再放回冰上。上样于 6 %测序胶,然后用 1 ×测序 TBE 缓冲液,在 45 ~ 50 ℃ 3000~4000V 下电泳,直至溴酚蓝走到凝胶底部。电泳过程中,为保持凝胶温度在 45 ~ 50 ℃ ,可能需要加大电压。
11. 甲醇 / 乙酸 /H2 O ( 5 : 5 : 90 )固定凝胶 15 分钟后,将胶移至 Whatman 3MM 滤纸上用凝胶干燥器干燥。
12. 把干燥凝胶对 X 光片在- 80 ℃曝光过夜,需使用增感屏。