经典cDNA文库构建方法介绍
互联网
- 相关专题
基因的结构、功能分析及其表达调控是现代生命科学研究中的主要课题,而基因的分离和纯化是研究的基础。基因文库的构建使基因的分析变得简单而快捷。真核或原核细胞的染色体DNA经物理或化学方法使基因组DNA分裂成为一定大小的片段,而后选择适当的载体与这些片段进行体外重组 ,并将这些重组体转染细菌后,可得到一组含有不同DNA片段的分子克隆混合体称为DNA文库。
cDNA文库 是由mRNA反转录后获得的cDNA,是在某种特定的细胞及特定状态下的全部cDNA克隆,因此,只有细胞内存在mRNA,才能建成相应的cDNA文库。而且,不同种类不同状态的细胞有不同的cDNA文库。所以,cDNA文库中所含有的特异性基因片段反映了组织或细胞中特定阶段表达蛋白质的编码基因,而且,这些编码基因所含序列是既可被转录又能被翻译的外显子部分,而不含有内含子。
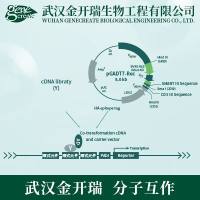
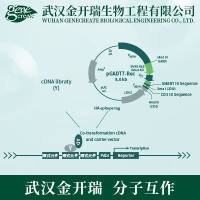
cDNA文库分为非表达型和表达型二种:非表达型cDNA文库多用λgt10作为载体。λgt10系免疫区插入载体家族中的一员,非重组 的λgt10长约43kb,最多可插入长7.6kb的外源性DNA,重组与非重组的λgt10可根据其所形成的噬菌斑表型加以区别。构建于λgt10的基因文库可用核酸探针进行筛选;表达型cDNA文库用λgt11作为载体。λgt11是一个表达载体,可插入全长约7.2kb的外源性DNA片段,其表达的融合蛋白氨基端为β-半乳糖苷酶序列而羧基端为外源多肽。与非表达型相比较,表达型载体插入的cDNA片断最终以融合蛋白形式表达,蛋白保持原有的抗原性与生物活性,该文库可用与表达蛋白能特异结合的抗体或与表达蛋白特异结合的受体进行筛选,因此,该类文库特别适用于氨基酸序列不清楚的蛋白质的筛选。下面是具体介绍cDNA文库的构建方法。
经典cDNA文库 的构建方法
一、 mRNA提取 (略)
二、 合成cDNA第一链
试验试剂
1、 poly(A)+RNA(1mg/ml)
2、 核苷酸引物(1mg/ml)
3、 鼠反转录酶(M-MLV)
4、 dNTP溶液(含有4种dNTP,每种5mmol/L)
5、 1mol/L MgCl2,1mol/L KCl
6、 0.1mol/L二硫苏糖醇(DDT)
7、 1mol/L Tris-HCl(pH8.3)
8、 10mCi/mlα-32P-dCTP
9、 DEPC(核酸酶抑制剂)
10、 RNase 抑制剂
实验步骤
1、 无菌离心管中加入以下试剂:10μl poly(A)+mRNA(1mg/ml),1μl寡核苷酸引物(1mg/ml),1mol/L Tris-HCl(pH 8.0,370C)2.5μl,1mol/L KCl 3.5μl,250mmol/L MgCl2 2μl,dNTP溶液10μl,0.1mol/L DDT 2μl,RNase 抑制剂25U,加水至48μl,加入2μl M-MLV,温和振荡混匀。
2、 取2.5μl以上混合物至另一微量离心管中,加入0.1μlα-32P-dCTP, 两管370C温浴1h。
3、 第一离心管700C温浴10min后放于40C;含同位素的微量离心管中加入1μl 0.25mol/L EDTA,取0.5μl计算总放射性和三氯乙酸(TCA)放射性。3 s: v# 9 w1 ]) d K7 S& r( H
4、 cDNA第一链合成量为:合成的cDNA第一链(μg)=掺入的活度值(cpm)/总活度值(cpm)×66(μg)
三、 合成cDNA第二链
试验试剂
1、 cDNA第一链,dNTP溶液(含有4种dNTP,每种10mmol/L)
2、 α-32P-dCTP(10mCi/ml)
3、 1×104U/ml Ecoli DNA聚合酶Ⅰ
4、 1×104U /ml Ecoli DNA连接酶)
5、 2.5U/μl T4噬菌体DNA聚合酶
6、 30U/μl T4 噬菌体多核苷酸激酶
7、 50mmol/Lβ-烟酰胺腺嘌呤二核苷酸
8、 1000U/ml RNaseH
9、 氯仿,酚:氯仿(1:1,V:V)
10、 无水乙醇
11、 1mol/L MgCl2
12、 1mol/L(NH4)2SO4
13、 2mol/L Tris-HCl(pH7.4)
14、 0.5mol/L EDTA (pH8.0)
15、 TE(pH7.6)
16、 10×T4 噬菌体多核苷酸激酶缓冲液:700mmol/L Tris-HCl(pH7.6),100mmol/L MgCl2,50mmol/L二硫苏糖醇(DTT)。
实验步骤 :
1、 在第一链反应混合物中加入:2mol/L Tris-HCl(pH7.4)5μl,10mmol/L MgCl2 70μl,10mCi/mlα-32P-dCTP10μl,1mol/L(NH4)2SO4 1.5μl,RNaseH (1000U/ml) 1μl,大肠杆菌DNA聚合酶Ⅰ(1×104/ml) 4.5μl,温和振荡混匀, 1600C温浴4h。
2、 在反应物中加入:50mmol/Lβ-NAD 1μl, Ecoli DNA连接酶1μl,室温温浴15min。
3、 加入dNTP溶液(含4种dNTP,每种10mmol/L)1μl,5U T4噬菌体DNA聚合酶,混合后室温温浴15min。
4、 取1μl反应液测定总放射性和TCA沉淀放射性。合成的cDNA第二链(μg)=掺入的活度值(cpm)/总活度值(cpm)×(66μg-cDNA第一链量)
5、 将0.5mol/L EDTA (pH8.0) 5μl,加入剩余的反应物中,用酚:氯仿和氯仿分别抽提混合物一次,乙醇沉淀回收DNA,将DNA溶解在90μl TE(pH7.6)液中,加入10×T4 噬菌体多核苷酸激酶缓冲液10μl,30U/μl T4多核苷酸激酶1μl,室温温浴15min。然后用等量的酚:氯仿抽提。
6、 SepHadex G-50 用含有NaCl的TE液平衡后,分离未掺入的dNTP和α-32P-dCTP,最后用70%的乙醇洗涤沉淀物,弃乙醇干燥后用80μl TE(pH 7.6)溶解。
四、 cDNA甲基化
cDNA第二链合成后得到的cDNA在与载体连接时需在末端加上EcoRⅠ接头,当带有EcoRⅠ位点的双链接头加到cDNA上后,必须要进行相应的酶切以产生粘性末端,cDNA甲基化后可保护双链cDNA的内部酶切位点不被EcoRⅠ切割。
试验试剂:
1、 双链cDNA
2、 8×104U/ml EcoRⅠ甲基化酶
3、 20mmol/L S-腺苷甲硫氨酸
4、 氯仿,酚:氯仿(1:1,V:V)
5、 乙醇
6、 5mol/L NaCl
7、 2mol/L Tris-HCl(pH8.0)
8、 0.5mol/L EDTA(pH 8.0)
9、 TE(pH8.0)
实验步骤:
1、 在80μl cDNA 溶液中加入: 2mol/L Tris-HCl(pH8.0)5μl, 5mol/L NaCl 2μl, 0.5mol/L EDTA(pH8.0)2μl,20mmol/L S-腺苷甲硫氨酸 1μl,加双蒸水至98μl,加入2μl EcoRⅠ甲基化酶(8×104U/ml), 370C温浴1h,680C 15min。
2、 用等体积的酚/氯仿抽提一次,氯仿抽提一次,40C 12000g离心15min, 沉淀用70%乙醇洗涤后溶于30μl TE(pH8.0)。
五、 cDNA与连接子连接及连接后cDNA的过滤分离
试验试剂:
1、 EcoRⅠ酶
2、 1×104U/ml T4噬菌体DNA连接酶
3、 500U/mlT4噬菌体DNA聚合酶
4、 已磷酸化的连接子(EcoR
5、 dNTP溶液(含有4种dNTP,每种5mmol/L)
6、 0.5mol/L EDTA (pH8.0)
7、 TE(pH8.0)
8、 酚:氯仿(1:1,V:V)
9、 3mol/L乙酸钠(pH5.2)
10、 乙醇
11、 10mmol/L Tris-HCl (pH8.0)
12、 10×T4噬菌体DNA聚合酶缓冲液:330mmol/L Tris-乙酸(pH 8.0),660 mmol/L乙酸钾,100mmol/L乙酸镁,5mmol/L 二硫苏糖醇,1mg/ml牛血清白蛋白
13、 10×EcoRⅠ酶缓冲液:1mol/L乙酸钾,250 mmol/L Tris-乙酸(pH7.6),100mmol/L四氢乙酸镁,5mmol/Lβ巯基乙醇,0.1mg/ml牛血清白蛋白
14、 10×T4噬菌体DNA连接酶缓冲液:200mmol/L Tris-HCl(pH7.6),50mmol/L MgCl2,50mmol/L二硫苏糖醇
15、 TEN缓冲液:10mmol/L Tris-HCl(pH8.0),1mmol/L EDTA(pH8.0),100mmol/L NaCl
实验步骤
cDNA末端削平
1、 DNA 680C加热5min,冷却至370C后,加入5×T4噬菌体DNA聚合酶缓冲液10μl,dNTP溶液(含有4种dNTP,每种5mmol/L)5μl,加双蒸水至50μl。
2、 加1-2U的T4噬菌体DNA聚合酶,370C温浴15min。
3、 加入0.5mol/L EDTA (pH8.0)1μl以终止反应。
4、 酚:氯仿抽提,SepHadex G-50离心柱层析,除去未掺入的dNTP。
5、 乙醇沉淀后,溶于13μl 10mmol/L Tris-HCl (pH8.0)。
与连接子的连接
1、 在已削成平末端的cDNA中加入:10×T4噬菌体DNA连接酶缓冲液 2μl,已磷酸化的连接子800-1000ng(EcoRⅠ)2μl,1×104U/ml T4噬菌体DNA连接酶2μl,10mmol/L ATP 2μl,混匀后160C温浴8-12h。
2、 加入10×EcoRⅠ缓冲液 20μl,双蒸水150μl,EcoRⅠ酶 200U,混匀后370C温浴2h。
3、 加热680C 15min后,酚:氯仿抽提、乙醇沉淀纯化回收cDNA,cDNA溶于20μl TE(pH8.0)中。
cDNA的过滤分离
将cDNA插到载体之前,装有连接子的cDNA要经过进一步的分离,以除去未连接的连接子及长度小于500 kb的cDNA片断,这样将会增加文库中全长mRNA 的数量,且减少了需要筛选的重组子的数目。
1、 反应产物进行SepHaroseCL-4B柱层析,平衡缓冲液用含0.1mol/L NaCl的TE(pH7.6)。
2、 收集带有放射活性的流出液,每管约60μl,直至将所有的放射性洗脱出柱为止。
3、 从每一管中取出5μl,以末端标记的已知大小(0.2kb-5 kb)的DNA片断作标准参照物,通过1%的琼脂糖凝胶电泳进行分析,根据放射自显影结果,收集0.5kb以上的cDNA。
4、 加入0.1倍体积3mol/L的乙酸钠(pH5.2)和二倍体积的乙醇,40C放置15 min使cDNA沉淀,40C 12000g离心15min,沉淀干燥后溶于30μl 10mmol/L Tris-HCl(pH7.6)。
六、 cDNA与载体的重组连接、重组DNA的体外包装和转染
试验试剂:
1、 大肠杆菌菌株
2、 包装蛋白混合物
3、 λ噬菌体DNA
4、 1×104U/ml T4噬菌体DNA连接酶
5、 10×T4噬菌体DNA连接酶缓冲液:200mmol/L Tris-HCl(pH7.6),50mmol/L MgCl2,50mmol/L 二硫苏糖醇。
6、 SM培养基:NaCl 5.8g,MgSO4.7H2O 2g,1mmol/L Tris-HCl (pH7.5)50ml,2%明胶溶液5ml加水至1L,高压灭菌20min
实验步骤
1、 离心管中加入收集的大于500bp的cDNA片断50 ng,λ噬菌体DNA 0.5μg,10×T4 DNA连接酶缓冲液 1μl,T4噬菌体DNA连接酶1μl (1×104U /ml),加双蒸水至10μl混匀后160C温浴12h。
2、 包装蛋白混合物加入体外连接的噬菌体DNA进行包装,完成后加入0.5ml SM培养基,稀释包装后的噬菌体感染宿主菌,根据产生的噬菌斑数测定转染效价,据之将剩余的噬菌体全部感染宿主菌。
七、 cDNA文库的扩增
已构建好的cDNA文库可直接用于实验研究,但为了长期使用的需要,一般将cDNA文库扩增后低温长期保存。载体为λgt10噬菌体时选用EcoliBNN102为宿主菌;λgt11一般适用EcoliY1090作为宿主菌。
试验步骤:
1、 105个噬菌体感染大肠杆菌,铺平板,加入15mlSM培养基,室温振荡2h。
2、 回收SM培养基,7000g离心30min后,上清分装每管1ml,加入20-30μl氯仿,40C保存,若要长期保存加入甘油,-700C保存。
注意事项:
1. 在mRNA的分离过程中,因为mRNA的含量很低,且多为低丰度mRNA,所以在操作过程中一定要选基因拷贝数高,表达旺盛的组织作为分离mRNA的材料,此外,对实验的器皿、试剂一定要严格无RNase处理,防止RNA的降解。
2. 在cDNA第一链合成过程中,逆转录酶是关键,建议使用缺失RnaseH的鼠反转录酶(M-MLV),且在反应中加入一定量的RNase抑制剂。
3. 克隆时选用合适的载体,λgt10为常用的非表达型载体,λgt11是常用表达型载体,在其基础上衍生了一系列其它的载体如λgt18、λgt19,另外,还有λZAP,这些载体根据适当的情况选用。
cDNA文库的构建方法现今已经很成熟,但是经典的cDNA文库的构建方法仍然具有一些不足之处,例如在构建cDNA文库时需要的mRNA量较大,就要求有足够的原材料,对于原材料少的就无法建立cDNA文库;而且经典cDNA文库构建工作繁杂,耗时较长。