【转帖】RNA干扰技术研究进展及其应用
丁香园论坛
2291
RNA干扰介绍 (2006年诺贝尔医学奖)
据诺贝尔奖官方网站消息,10月2日当地时间上午11时30分(北京时间17时30分),瑞典皇家科学院诺贝尔奖委员会宣布将2006年度诺贝尔生理学或医学奖授予两名美国科学家安德鲁-费里和克拉格-米洛,以表彰他们发现了RNA干扰现象。费里和米洛将分享奖金。
因此,搜集了一点相关资料与大家共同学习。请斑竹酌情加分。
RNA干扰技术研究进展及其应用
作者单位:云南农业大学动物科学技术学院,昆明 650201
1998年Fire等首次把双链RNA(dsRNA)注射入一种线虫?(caenorhabditiselegans)体内,dsRNA使互补的mRNA降解,诱导了靶向性的基因表达沉默(genesilencing),这一现象称为RNA干扰(RNA interference,RNAi)。同植物中的共抑制(co?suppression)或转录后基因沉默(post?transcriptional gene silencing,PTGS)、真菌中的基因表达压抑(quelling)一样,RNAi也是一种典型的转录后基因表达调控方式,是美国《Science》和《Nature》评出的2002年度最重要的科技成果之一,正成为基因功能研究和基因治疗研究的热点。康奈尔大学的Guo等(1995)利用反义RNA(antisense RNA)技术特异性地阻断秀丽新小杆线虫?(C. elegans)?中的par?1基因的表达以期得到与对照组注射正义RNA(sense RNA)相反的结果,但最终的结果却令他们费解:二者同样阻断了par?1基因的表达途径。直到1998年,Fire等的研究结果证明,在正义RNA也阻断了基因表达的试验中,真正起作用的是双链RNA,这些双链RNA是体外转录正义RNA时生成的,这种双链RNA对基因表达的阻断作用被称为RNAi。随后的研究结果发现,RNAi现象在多种生物中存在,如线虫、果蝇、斑马鱼、真菌以及植物等,生物体可利用RNAi来抵御病毒的感染,阻断转座子的作用(Zamore等,2000)。?
1999年Tuschl等报道在哺乳动物中也存在RNAi,只是导入的RNA是小干扰RNA(small interferingRNA,siRNA)(Tuschl等,2002);2001年Berstein等提出:只有22核苷酸(nt,nucleotide)才能特异性地阻断dsRNA,同时他们还发现了体内一个分解dsRNA为siRNA的叫Dicer的酶(Agami2002)。近几年来RNAi的研究取得了很大进展,他被《Science》杂志评为2001年的十大科学成就之一。2002年RNAi的研究又有了新的突破,发现他在基因表达调控中发挥重要作用,他也名列2002年《Science》杂志评的十大科学成就之首。?
1 RNAi生物学意义
转座因子和病毒等外源核酸的引入能破坏宿主细胞基因组的稳定性。转录后基因沉默,就是宿主将外源基因视为对自身有害的序列而抑制其表达。细胞对外源核酸的这种抑制作用具有序列特异性的特点,细胞转录后基因沉默机制启动后,细胞对外源核酸的同源序列就具有了抑制其表达能力,是生物体在进化过程中形成的一种维护自身稳定性的防御手段。?
RNAi主要发生在胞浆中,也可发生在细胞核中。在RNAi过程中,目的基因DNA没有发生改变,转录过程仍在进行,但细胞核和细胞浆中同源mRNA减少,蛋白合成降低,引起特异基因表达抑制,说明RNAi现象发生在转录后,蛋白质合成前。RNAi现象的机制目前还没有完全弄清楚,涉及到很多不明功能的酶和蛋白质,其中已鉴定出的与RNAi相关的酶有双链RNA特异性核酸内切酶Dicer,RNA依赖的RNA聚合酶RdRP。Dicer是RNAi作用的关键成分,具有解旋酶活性及dsRNA结合域和PAZ结构域,属于ribonucleaseⅢ超家族的一员,在进化上非常保守,能特异性切割双链RNA,产生siRNA;siRNA是RNAi作用的重要组分,是RNAi发生的中介分子。
2 RNAi的作用机制
RNAi属于转录后基因沉默机制,其本质是siRNA高效、特异地阻断体内同源基因表达,致使mRNA降解和基因表达受抑。研究结果表明,RNAi广泛存在于各种生物体,植物、真菌、锥虫、果蝇和哺乳动物中都发现了RNAi现象(Agami,2002)。自然界中,RNAi可能是动植物体内的一种保护机制,主要作用在于防御病毒感染,维持基因组中转座子的稳定,参与胚胎发育等。RNAi的具体机制和过程尚未十分清楚,可能的作用机制是细胞内双链RNA在Dicer酶的作用下,可形成22 bp大小的siRNA,siRNA可进一步掺入多部分核酸酶(multicomponent nuclease,RISC)并使其激活,从而精确降解与siRNA序列相同的mRNA,完全抑制了该基因在细胞内的翻译和表达。?
RNA酶Ⅲ是一种能切割双链RNA的酶,参与RNAi反应的Dicer酶是RNA酶Ⅲ家族的一个成员。Dicer酶广泛存在于蠕虫、真菌、植物及哺乳动物体内,他的结构中包括1个螺旋酶结构域,2个RNA酶Ⅲ结构域,1个双链RNA结合位点。在Dicer酶的作用下,双链RNA被裂解成21~23个核苷酸的siRNA,他启动了细胞内的RNAi反应(Bernstein等,2001)。因少量双链RNA即能阻断基因表达,且此效应可传至子代细胞,研究者们推测细胞内存在RNAi效应的扩增系统。研究者们发现,在真核细胞中也存在能以RNA为模板指导RNA合成的聚合酶(RNA?directed RNA polymerase,RdRP)。在RdRP的作用下,进入细胞内的双链RNA通过类似于PCR的反应过程,呈指数级的数量扩增。双链RNA进入细胞后,一方面在Dicer酶的作用下被裂解成小片段siRNA,另一方面在RdRP的作用下自身扩增后,再被Dicer酶裂解成siRNA。小片段siRNA生成后与核酸酶形成复合物,随后mRNA与小片段的正义链置换,被mRNA替代。mRNA的位置与最初正义链的位置相同,从而被核酸酶在相同的位点降解。更有意义的是mRNA的降解使核酸酶得以再生,这样周而复始,mRNA得以降解,因此RNAi呈酶解动态(Svoboda等,2000)。?
由于mRNA也以21~23 nt的特定间隔降解,因此认为降解dsRNA与mRNA的核酸酶相同。另一方面以siRNA作为引物,以mRNA为模板,在RdRP作用下合成出mRNA的互补链。结果mRNA也变成了双链RNA,他在Dicer酶的作用下也被裂解成siRNA。这些新生成的siRNA也具有诱发RNAi的作用,通过这个聚合酶链式反应,细胞内的siRNA大大增加,显著增加了对基因表达的抑制(Tuschl等,2002;Agami,2002;Bernstein等,2001)。RNAi不同于其他基因阻断技术,他是转录后水平的基因静默机制,因此注射该基因的内含子或者启动子顺序的dsRNA都没有干涉效应。RNAi具有较高的特异性,能够非常特异地降解与之序列相应的单个内源基因的mRNA,且抑制基因表达效率很高,相对少量的dsRNA就可以使表型达到缺失突变体程度,但dsRNA需要一个最小的长度才能产生有效的干扰效果。dsRNA小片段如小于21~23 nt (如10~15 nt),特异性将显著降低,不能保证不与细胞内非靶向基因相互作用,如远远大于21~23 nt,互补序列可能延伸,超出抑制范围。RNAi基因表达的效应可以突破细胞界限,在不同细胞甚至生物体间长距离传递和维持,并可传递给子一代(Svoboda等,2000)。
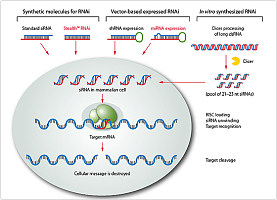
3 RNAi在细胞中的研究和双链RNA的构建
3.1 小鼠胚胎细胞中也存在RNAi Billy等(2001)的研究结果表明,在小鼠的胚胎细胞中也存在RNAi。将727个碱基对的双链RNA转入小鼠的畸胎瘤细胞,诱发了细胞内的RNAi机制,并抑制了报告基因的表达。但大于30个核苷酸的双链RNA进入哺乳动物的成体细胞后,会非特异的阻断基因的表达。因为长的双链RNA进入哺乳动物成体细胞后,细胞内的病毒防御机制被激活; 且RNAL(RNase L)被激活,产生非特异的mRNA降解。而未分化的胚胎细胞中,上述防御病毒的机制存在缺陷,因而双链RNA能特异的阻断基因的表达,但Tuschl等的研究克服了这一障碍,他们发现,21个核苷酸的双链RNA能够诱发哺乳动物细胞内的RNAi机制,同时不会激活细胞内的干扰素(Elbashir等,2001)。他们合成了以荧光素酶的mRNA为靶分子的21个核苷酸的双链RNA,将他和荧光素酶的表达质粒用脂质体共转染到NIH3T3、COS?7、Hela S3和293细胞中,报告基因的表达被抑制了90%。由于报告基因得到的结果不能完全说明细胞内的情况,他们又合成了细胞内源性基因laminA/C为靶目标的双链RNA,这个双链RNA也特异的抑制了laminA/C的表达,抑制率达到90%以上。?
3.2 双链RNA的构建 双链RNA可先在体外构建好,用脂质体转染细胞,但有些细胞脂质体转化效果差,转化到细胞内的双链RNA半衰期短,而先在体外构建能表达双链RNA的载体,再将载体转到细胞内合成出双链RNA,不但能增加有效转染细胞的种类,而且在长期稳定表达载体的细胞株中,双链RNA能够长期发挥阻断基因的作用。构建双链RNA表达载体,使用RNA多聚酶Ⅲ指导RNA的合成,因为RNA多聚酶Ⅲ有明确的启始和终止序列,当RNA多聚酶Ⅲ遇到连续5个胸腺嘧啶时,他指导的转录就会终止,且转录产物在第2个尿嘧啶处被切下来,因此合成的RNA无polyA尾。U6启动子能被RNA多聚酶Ⅲ识别,合成出RNA。Sui等(2002)用bluescript作为载体,RNA多聚酶Ⅲ可识别的U6作为启动子,从绿色荧光蛋白(GFP)的基因上选择了一个21个核苷酸的片段(片段1),将其插入到bluescript载体中,然后合成出片段1的反向重复序列,并在其后加了5个胸腺嘧啶,称为片段2。他们将片段2接到bluescript载体中片段1的后面,将载体转移到细胞中后,转录出的RNA由于具有回文序列,会形成一个发卡样结构,从而得到了双链RNA。片段后面加了5个胸腺嘧啶,RNA转录到这个位置时就会终止,而且转录出的RNA形成发卡样结构后,会在3′端形成2个突出的尿嘧啶,这类似于天然的siRNA,因而有利于双链RNA诱发RNAi。RNA多聚酶Ⅲ亦识别H1?RNA启动子,在H1?RNA启动子后面接上能形成发卡样结构的反向互补序列,将此载体转入细胞后也能在细胞内合成dsRNA(Brummelkamp等,2002)。T7也可作为启动子合成dsRNA,将PCR产物用NotI酶切后自身连结,回收正向片段和反向片段连结形成的具有反转重复序列的片段,接到pGEMTeasy载体上,就构建成了可以表达dsRNA的载体。用此载体可先在体外合成dsRNA,或将其转入到细胞内合成dsRNA。在后一种情况下,还须将能表达T7RNA多聚酶的载体也一起转入到细胞中,以提供能识别T7启动子的RNA多聚酶(Yang等,2001)。腺病毒是体内转基因的常用载体,Xia等(2002)用腺病毒做载体,在体内和体外表达dsRNA,并成功的阻断了基因的表达。?
4 RNAi的试验方法
双链RNA在Dicer作用下生成的siRNA是RNAi作用的重要组分,具有互补的双链结构,在3′端带有2个突出碱基,是RNAi发生的中介分子。目前,诱导RNA干扰有很多种方法,各有其优缺点:①化学合成法,应用最广泛但成本昂贵,体外合成的长为21nt,3′端带有2个突出碱基的siRNA较其它形式合成的RNA具有最大效率的降解目的mRNA的效果,突出碱基为核糖核酸较突出碱基为脱氧核糖核酸具有更大的诱导效果,一个碱基的错配,能明显的降低干扰的效率 ;②siRNA表达载体,在质粒或病毒载体中,利用RNA聚合酶启动子U6或T7分别控制正义链和反义链的合成并在细胞内退火形成双链siRNA,或在聚合酶启动子下游设计带发夹结构的表达单位,表达后自身退火形成双链siRNA;③利用载体表达长的dsRNA,多用于果蝇、线虫等低等生物中,在体内表达后被Dicer切割成?21~?23 nt的SiRNA,引发特异地基因表达抑制;或在体外利用Dicer、RNaseⅢ切割dsRNA,产生siRNA,纯化后使用;长的dsRNA在哺乳动物细胞中能激发非特异性反应;但已有研究结果表明在鼠胚胎或胚胎细胞系中,长500 nt的dsRNA也能诱发特异的基因表达抑制。??
5 RNAi技术的应用
依据RNAi现象,科学家建立了RNAi技术,即人为设计合成针对某特定基因序列的dsRNA来关闭或抑制该基因的表达。dsRNA的合成包括化学合成法、体外转录法、转录载体体内转录法等。其中,以DNA为模板体内合成siRNA载体的成功应用,为RNAi的研究提供了更为简便和实用的方法,使RNAi技术真正成为了可被广泛采用的有力工具(Miyagishi等,2002)。?
RNAi技术在基因功能的研究中具有许多传统方法无法比拟的特点和优势。首先,RNAi具有较高的特异性,只引起与dsRNA同源的mRNA降解。RNAi技术中siRNA序列选择余地大,21~23个核苷酸中只要改变1个核苷酸,就可以使该siRNA序列不对靶向mRNA起作用,因此RNAi可用来抑制单个核苷酸突变基因的表达。 ?
5.1 高通量研究基因功能 基因功能研究现在已经明确,双链RNAi技术不仅可抑制体外细胞中特定基因的表达,而且也可抑制体内特定基因的表达。在功能基因组研究中,需要对特定基因进行功能丧失或降低突变,以确定其功能。21 nt siRNA的双链复合物在哺乳动物细胞中干扰成功为基因作用的研究提供了一种新的工具,原来要花费6个月到1年才能明确1个哺乳动物细胞基因如何关闭,现在只需1个星期就能明确10个基因的关闭,使工作进程大大加快。可以预见,RNAi作为一种快速静默基因的途径,将会越来越多地用于哺乳动物基因研究。将功能未知的基因的编码区(外显子)或启动子区,以反向重复的方式由同一启动子控制表达。这样在转基因个体内转录出的RNA可形成dsRNA,产生RNAi,使目的基因静默,从而进一步研究目的基因的功能。根据所选用序列的不同,可将其分为编码区RNAi和启动子区RNAi(Xia等,2002)。线虫和果蝇的全部基因组序列已测试完毕,发现大量未知功能的新基因,RNAi将大大促进对这些新基因功能的研究(Zhang等,2003)。?
5.2 研究信号转导通路的新工具 由于RNAi能高效特异的阻断基因的表达,他成为研究信号传导通路的良好工具。在线虫体内,胰岛素和受体结合后可以活化Dsor1,他是Mek的类似物,Dsor1活化后可以激活EekA,他是ERK的类似物。用以Dsor1为靶目标的dsRNA可以阻断Dsor1的表达,虽然总的ErkA的表达不受影响,但由于Dsor1的表达被抑制,因而胰岛素刺激后ErkA不能活化(Morris等,2002)。
5.3 基因治疗的新方法 用RNAi特异性地抑制如艾滋病病毒基因、肝炎病毒基因、癌基因、癌相关基因或突变基因的过度表达,使这类基因保持在静默或休眠状态,从而有望用这种新的手段治疗各种病毒性疾病和恶性肿瘤等疑难病症。而肿瘤是多基因、多因素疾病,单个癌基因的抑制往往很难达到治疗效果,但RNAi技术能够同时抑制多个不同基因,而且抑制效果互不干扰。此外,RNAi识别可以精确到1个核苷酸,对由野生型点突变形成的癌基因,如ras,p53等,能够产生准确有效的封闭效果,野生型基因则不受影响。试验结果证明,bcl?2、CDK?2、PLK?1和p53等肿瘤相关基因的RNAi,能够使人类宫颈癌细胞(HeLa)增生速度减慢,恶性程度降低,凋亡加快。肝癌(Hep3B)、非小细胞肺癌(H1299)、头颈部鳞状细胞癌(C33?A)、骨肉瘤(U?2OS)及前列腺癌(LNCaP)(Lin等,2001)、白血病(Wilda等,2002)等细胞系中的试验也发现类似效应。此外,将RNAi应用于Wilson病等先天遗传性疾病的体外试验也获得令人满意的结果(Oh等,2002;Hannon等,2004;Celotto等,2004;Tang等,2004;Vi?tei等,2004;Hsieh等,2004;Caplen等,2003;Yoshinari等,2004;Kwong等,2004)。2002年9月,科学家采用这项技术完全清除了生长在试管中的所有癌细胞,而未伤及正常细胞。随着这一研究结果近日的公布,另一个小组的研究人员正设计这一技术在世界上的第一次临床试验,该试验将在一组艾滋病患者中进行。由于双链RNA干涉,通过使有害的基因“静默”而奏效,因而科学家认为,可用其来静默感染的病毒基因或已转为恶性的肿瘤细胞,从而使他们变得无害。?
5.4 反向遗传学上的应用 随着各种模式生物和人类基因组测序的完成,基因功能的研究远远落后于大量序列所提供的信息,研究和发现基因的功能成为越来越紧迫的任务。长期以来,破坏基因结构或抑制基因或基因簇的表达是研究该基因功能的重要方法,如常用的基因敲除技术 (gene knock?out)。基因敲除技术对所研究的基因要有详细的认识,较长的时间才能决定基因与表型的关系。自RNAi现象发现后,因其操作简单,作用迅速,具有较高的特异性,获得了生物学家的青睐,首先应用于反向遗传学和基因功能的研究,尤其是植物和低等生物如病原微生物,能迅速而方便地使某个基因失去功能。因而,能更快的决定基因与表型的关系。RNAi技术还具有的一个优势是能同时对多个基因或基因家族进行研究,或应用于研究mRNA差别剪接形成的异构体,甚至在基因组水平上构建针对基因组的RNAi表达载体,对于研究基因之间的相互作用和进行基因功能的高通量筛查,具有更大的优势。相对于基因敲除技术长期抑制基因功能,RNAi技术仅仅是使基因表达暂时降低或抑制“knock-down”,基因组的信息仍是完整的。利用RNA干扰技术先封闭基因的表达,然后再激活,通过前后基因表型的变化,能很方便的鉴定出基因的功能。?
线虫是研究RNAi现象的最好模式生物,dsRNA可通过浸泡在含dsRNA的溶液中,喂食表达dsRNA的细菌或注射的方式导入线虫体内,诱导RNAi现象。Ahringer等应用RNAi技术研究了秀丽线虫的基因组(覆盖了1/3的基因组),提供了大量的有关线虫发育和生存必需基因的知识。RNAi技术为研究发育过程中基因的功能提供了一个手段,能很容易地制造出突变型个体。Amdam等把dsRNA注入囊胚前期的蜜蜂卵或初生蜜蜂腹内,封闭vitellogenin基因的表达(vitellogenin 基因在成体后才出现表型),结果分别有15%和96%的个体出现突变型。15 d后,仍能检测到dsRNA片段 。在进行反向遗传学研究时,RNA干扰技术也能用来寻找药物治疗靶点,Hideo等利用RNAi技术减少了丘脑下部AGRP(agouti?related peptide)50%的表达量,AGRP使代谢率提高而不用减少摄食量,从而减轻肥胖,为肥胖的治疗提供了一个靶点。用于疾病机理研究,针对Fas 介导的信号通路在肝脏疾病中的作用,在鼠模型中,利用RNAi技术干扰Fas通路能明显降低自身免疫性肝炎引起的肝衰竭和纤维化,说明了Fas通路在肝脏疾病中所起的作用。?
6 问题与展望
RNAi技术有望应用于临床以前,应解决几个问题:①在设计表达siRNA的载体或合成siRNA时,1个碱基的差别将会明显的降低RNAi的效率;另外,Torgeir等研究结果表明,针对mRNA的不同位点,化学合成的siRNA具有不同的诱导RNAi效率,提示在人类mRNA中,能有效诱导RNAi的位点有限,因此要筛选有效位点,确保治疗效果;②siRNA转导入细胞中的效率有待提高,这是RNA干扰技术应用于临床的主要障碍,在培养的细胞中取得较高的转导效率,在体内不一定有这么高的效率,应发展更好更有效的转移载体,能进入细胞内稳定的表达siRNA;③siRNA的稳定性和作用的长期性,siRNA很容易被细胞中的Rnases降解而失效;用DNA质粒和病毒载体表达有茎环结构的siRNA能减少降解,提高RNA干涉的效果和维持较长的作用时间。载体表达的siRNA比化学合成的siRNA具有更高的稳定性,在体内作用也更持久,在将来的基因治疗中,应具有更广阔的应用前景。④各种表达载体或合成RNA的毒性作用还有待研究。?
随着RNAi机理的逐步阐明,RNAi技术正以令人兴奋的速度发展,并不断开辟新的应用领域,各种更好更有效的载体和转移系统的建立,为深入研究和应用提供了前提。RNAi技术在反向遗传学和临床治疗中定会取得更大的成果。?
参考文献
1 Agami R. Curr Opin Chem Biol,2002,6:829~834.?
2 Bernstein E, et al. Nature,2001,409:363~366.?
3 Billy E, et al. Proc Natl Acad Sci USA,2001,98:14428~14433.?
4 Brummelkamp T R, et al. Science,2002,296:550~553.?
5 Caplen N J, et al. Ann N Y Acad Sci,2003,1002:56~62.?
6 Celotto A M, et al. Methods Mol Biol,2004,257:245~254.
7 Elbashir S M, et al. Nature,2001,411:494~498.?
8 Fire A, et al. Nature,1998,391:806~811.?
9 Guo S, et al. Cell,1995,81:611~620.
10 Hannon G J, et al. Methods Mol Biol,2004,257:255~266.?
11 Hsieh A C, et al. Nucleic Acids Res,2004,32:893~901.?
12 Kwong S M, et al. Mol Microbiol,2004,51:497~509.?
13 Lin S L, et al. Biochem Biophys Res Commun,2001,281:639~644.?
14 Miyagishi M, et al. Nucleic Acids Res Suppl,2002,2:113~114.?
15 Morris J C, et al. EMBO J,2002,21:4429~4438.?
16 Oh W J, et al. Eur J Biochem,2002,269:2151~2161.?
17 Sui G H, et al. Proc Natl Acad Sci USA,2002,99:5515~5520.?
18 Svoboda P, et al. Development,2000,127:4147~4156.?
19 Tang G, et al. Methods MolBiol, 2004,257:223~244.?
20 Tuschl T, et al. Biochim Biophys Acta,2002,1575:15~25.?
21 Ui?Tei K, et al. Nucleic Acids Res,2004,32:936~948.?
22 Wilda M, et al. Oncogene,2002,21:5716~5724.
23 Xia H B, et al. Nat Biotechnol,2002,20:1006~1010.
24 Yang S H, et al. Mol Cell Biol,2001,21:7807~7816 .
25 Yoshinari K, et al. Effects on RNAi of the tight structure, sequence and position of the targeted region Nucleic Acids Res,2004,32:691~699.
26 Zamore P D, et al. Cell,2000,101:25~33.
27 Zhang L, et al. Biochem Biophys Res Commun,2003,303:?1169~?1178.
另找了2006年发表的几篇国内综述,
RNAi的抗病毒研究进展
RNA干扰及其抗病毒研究
RNA干扰及其在肿瘤研究中的应用
RNA干扰研究进展
RNA干扰用于基因治疗的研究进展
RNA干扰在肿瘤研究中的进展
基因沉默的新技术:RNA干扰
据诺贝尔奖官方网站消息,10月2日当地时间上午11时30分(北京时间17时30分),瑞典皇家科学院诺贝尔奖委员会宣布将2006年度诺贝尔生理学或医学奖授予两名美国科学家安德鲁-费里和克拉格-米洛,以表彰他们发现了RNA干扰现象。费里和米洛将分享奖金。
因此,搜集了一点相关资料与大家共同学习。请斑竹酌情加分。
RNA干扰技术研究进展及其应用
作者单位:云南农业大学动物科学技术学院,昆明 650201
1998年Fire等首次把双链RNA(dsRNA)注射入一种线虫?(caenorhabditiselegans)体内,dsRNA使互补的mRNA降解,诱导了靶向性的基因表达沉默(genesilencing),这一现象称为RNA干扰(RNA interference,RNAi)。同植物中的共抑制(co?suppression)或转录后基因沉默(post?transcriptional gene silencing,PTGS)、真菌中的基因表达压抑(quelling)一样,RNAi也是一种典型的转录后基因表达调控方式,是美国《Science》和《Nature》评出的2002年度最重要的科技成果之一,正成为基因功能研究和基因治疗研究的热点。康奈尔大学的Guo等(1995)利用反义RNA(antisense RNA)技术特异性地阻断秀丽新小杆线虫?(C. elegans)?中的par?1基因的表达以期得到与对照组注射正义RNA(sense RNA)相反的结果,但最终的结果却令他们费解:二者同样阻断了par?1基因的表达途径。直到1998年,Fire等的研究结果证明,在正义RNA也阻断了基因表达的试验中,真正起作用的是双链RNA,这些双链RNA是体外转录正义RNA时生成的,这种双链RNA对基因表达的阻断作用被称为RNAi。随后的研究结果发现,RNAi现象在多种生物中存在,如线虫、果蝇、斑马鱼、真菌以及植物等,生物体可利用RNAi来抵御病毒的感染,阻断转座子的作用(Zamore等,2000)。?
1999年Tuschl等报道在哺乳动物中也存在RNAi,只是导入的RNA是小干扰RNA(small interferingRNA,siRNA)(Tuschl等,2002);2001年Berstein等提出:只有22核苷酸(nt,nucleotide)才能特异性地阻断dsRNA,同时他们还发现了体内一个分解dsRNA为siRNA的叫Dicer的酶(Agami2002)。近几年来RNAi的研究取得了很大进展,他被《Science》杂志评为2001年的十大科学成就之一。2002年RNAi的研究又有了新的突破,发现他在基因表达调控中发挥重要作用,他也名列2002年《Science》杂志评的十大科学成就之首。?
1 RNAi生物学意义
转座因子和病毒等外源核酸的引入能破坏宿主细胞基因组的稳定性。转录后基因沉默,就是宿主将外源基因视为对自身有害的序列而抑制其表达。细胞对外源核酸的这种抑制作用具有序列特异性的特点,细胞转录后基因沉默机制启动后,细胞对外源核酸的同源序列就具有了抑制其表达能力,是生物体在进化过程中形成的一种维护自身稳定性的防御手段。?
RNAi主要发生在胞浆中,也可发生在细胞核中。在RNAi过程中,目的基因DNA没有发生改变,转录过程仍在进行,但细胞核和细胞浆中同源mRNA减少,蛋白合成降低,引起特异基因表达抑制,说明RNAi现象发生在转录后,蛋白质合成前。RNAi现象的机制目前还没有完全弄清楚,涉及到很多不明功能的酶和蛋白质,其中已鉴定出的与RNAi相关的酶有双链RNA特异性核酸内切酶Dicer,RNA依赖的RNA聚合酶RdRP。Dicer是RNAi作用的关键成分,具有解旋酶活性及dsRNA结合域和PAZ结构域,属于ribonucleaseⅢ超家族的一员,在进化上非常保守,能特异性切割双链RNA,产生siRNA;siRNA是RNAi作用的重要组分,是RNAi发生的中介分子。
2 RNAi的作用机制
RNAi属于转录后基因沉默机制,其本质是siRNA高效、特异地阻断体内同源基因表达,致使mRNA降解和基因表达受抑。研究结果表明,RNAi广泛存在于各种生物体,植物、真菌、锥虫、果蝇和哺乳动物中都发现了RNAi现象(Agami,2002)。自然界中,RNAi可能是动植物体内的一种保护机制,主要作用在于防御病毒感染,维持基因组中转座子的稳定,参与胚胎发育等。RNAi的具体机制和过程尚未十分清楚,可能的作用机制是细胞内双链RNA在Dicer酶的作用下,可形成22 bp大小的siRNA,siRNA可进一步掺入多部分核酸酶(multicomponent nuclease,RISC)并使其激活,从而精确降解与siRNA序列相同的mRNA,完全抑制了该基因在细胞内的翻译和表达。?
RNA酶Ⅲ是一种能切割双链RNA的酶,参与RNAi反应的Dicer酶是RNA酶Ⅲ家族的一个成员。Dicer酶广泛存在于蠕虫、真菌、植物及哺乳动物体内,他的结构中包括1个螺旋酶结构域,2个RNA酶Ⅲ结构域,1个双链RNA结合位点。在Dicer酶的作用下,双链RNA被裂解成21~23个核苷酸的siRNA,他启动了细胞内的RNAi反应(Bernstein等,2001)。因少量双链RNA即能阻断基因表达,且此效应可传至子代细胞,研究者们推测细胞内存在RNAi效应的扩增系统。研究者们发现,在真核细胞中也存在能以RNA为模板指导RNA合成的聚合酶(RNA?directed RNA polymerase,RdRP)。在RdRP的作用下,进入细胞内的双链RNA通过类似于PCR的反应过程,呈指数级的数量扩增。双链RNA进入细胞后,一方面在Dicer酶的作用下被裂解成小片段siRNA,另一方面在RdRP的作用下自身扩增后,再被Dicer酶裂解成siRNA。小片段siRNA生成后与核酸酶形成复合物,随后mRNA与小片段的正义链置换,被mRNA替代。mRNA的位置与最初正义链的位置相同,从而被核酸酶在相同的位点降解。更有意义的是mRNA的降解使核酸酶得以再生,这样周而复始,mRNA得以降解,因此RNAi呈酶解动态(Svoboda等,2000)。?
由于mRNA也以21~23 nt的特定间隔降解,因此认为降解dsRNA与mRNA的核酸酶相同。另一方面以siRNA作为引物,以mRNA为模板,在RdRP作用下合成出mRNA的互补链。结果mRNA也变成了双链RNA,他在Dicer酶的作用下也被裂解成siRNA。这些新生成的siRNA也具有诱发RNAi的作用,通过这个聚合酶链式反应,细胞内的siRNA大大增加,显著增加了对基因表达的抑制(Tuschl等,2002;Agami,2002;Bernstein等,2001)。RNAi不同于其他基因阻断技术,他是转录后水平的基因静默机制,因此注射该基因的内含子或者启动子顺序的dsRNA都没有干涉效应。RNAi具有较高的特异性,能够非常特异地降解与之序列相应的单个内源基因的mRNA,且抑制基因表达效率很高,相对少量的dsRNA就可以使表型达到缺失突变体程度,但dsRNA需要一个最小的长度才能产生有效的干扰效果。dsRNA小片段如小于21~23 nt (如10~15 nt),特异性将显著降低,不能保证不与细胞内非靶向基因相互作用,如远远大于21~23 nt,互补序列可能延伸,超出抑制范围。RNAi基因表达的效应可以突破细胞界限,在不同细胞甚至生物体间长距离传递和维持,并可传递给子一代(Svoboda等,2000)。
3 RNAi在细胞中的研究和双链RNA的构建
3.1 小鼠胚胎细胞中也存在RNAi Billy等(2001)的研究结果表明,在小鼠的胚胎细胞中也存在RNAi。将727个碱基对的双链RNA转入小鼠的畸胎瘤细胞,诱发了细胞内的RNAi机制,并抑制了报告基因的表达。但大于30个核苷酸的双链RNA进入哺乳动物的成体细胞后,会非特异的阻断基因的表达。因为长的双链RNA进入哺乳动物成体细胞后,细胞内的病毒防御机制被激活; 且RNAL(RNase L)被激活,产生非特异的mRNA降解。而未分化的胚胎细胞中,上述防御病毒的机制存在缺陷,因而双链RNA能特异的阻断基因的表达,但Tuschl等的研究克服了这一障碍,他们发现,21个核苷酸的双链RNA能够诱发哺乳动物细胞内的RNAi机制,同时不会激活细胞内的干扰素(Elbashir等,2001)。他们合成了以荧光素酶的mRNA为靶分子的21个核苷酸的双链RNA,将他和荧光素酶的表达质粒用脂质体共转染到NIH3T3、COS?7、Hela S3和293细胞中,报告基因的表达被抑制了90%。由于报告基因得到的结果不能完全说明细胞内的情况,他们又合成了细胞内源性基因laminA/C为靶目标的双链RNA,这个双链RNA也特异的抑制了laminA/C的表达,抑制率达到90%以上。?
3.2 双链RNA的构建 双链RNA可先在体外构建好,用脂质体转染细胞,但有些细胞脂质体转化效果差,转化到细胞内的双链RNA半衰期短,而先在体外构建能表达双链RNA的载体,再将载体转到细胞内合成出双链RNA,不但能增加有效转染细胞的种类,而且在长期稳定表达载体的细胞株中,双链RNA能够长期发挥阻断基因的作用。构建双链RNA表达载体,使用RNA多聚酶Ⅲ指导RNA的合成,因为RNA多聚酶Ⅲ有明确的启始和终止序列,当RNA多聚酶Ⅲ遇到连续5个胸腺嘧啶时,他指导的转录就会终止,且转录产物在第2个尿嘧啶处被切下来,因此合成的RNA无polyA尾。U6启动子能被RNA多聚酶Ⅲ识别,合成出RNA。Sui等(2002)用bluescript作为载体,RNA多聚酶Ⅲ可识别的U6作为启动子,从绿色荧光蛋白(GFP)的基因上选择了一个21个核苷酸的片段(片段1),将其插入到bluescript载体中,然后合成出片段1的反向重复序列,并在其后加了5个胸腺嘧啶,称为片段2。他们将片段2接到bluescript载体中片段1的后面,将载体转移到细胞中后,转录出的RNA由于具有回文序列,会形成一个发卡样结构,从而得到了双链RNA。片段后面加了5个胸腺嘧啶,RNA转录到这个位置时就会终止,而且转录出的RNA形成发卡样结构后,会在3′端形成2个突出的尿嘧啶,这类似于天然的siRNA,因而有利于双链RNA诱发RNAi。RNA多聚酶Ⅲ亦识别H1?RNA启动子,在H1?RNA启动子后面接上能形成发卡样结构的反向互补序列,将此载体转入细胞后也能在细胞内合成dsRNA(Brummelkamp等,2002)。T7也可作为启动子合成dsRNA,将PCR产物用NotI酶切后自身连结,回收正向片段和反向片段连结形成的具有反转重复序列的片段,接到pGEMTeasy载体上,就构建成了可以表达dsRNA的载体。用此载体可先在体外合成dsRNA,或将其转入到细胞内合成dsRNA。在后一种情况下,还须将能表达T7RNA多聚酶的载体也一起转入到细胞中,以提供能识别T7启动子的RNA多聚酶(Yang等,2001)。腺病毒是体内转基因的常用载体,Xia等(2002)用腺病毒做载体,在体内和体外表达dsRNA,并成功的阻断了基因的表达。?
4 RNAi的试验方法
双链RNA在Dicer作用下生成的siRNA是RNAi作用的重要组分,具有互补的双链结构,在3′端带有2个突出碱基,是RNAi发生的中介分子。目前,诱导RNA干扰有很多种方法,各有其优缺点:①化学合成法,应用最广泛但成本昂贵,体外合成的长为21nt,3′端带有2个突出碱基的siRNA较其它形式合成的RNA具有最大效率的降解目的mRNA的效果,突出碱基为核糖核酸较突出碱基为脱氧核糖核酸具有更大的诱导效果,一个碱基的错配,能明显的降低干扰的效率 ;②siRNA表达载体,在质粒或病毒载体中,利用RNA聚合酶启动子U6或T7分别控制正义链和反义链的合成并在细胞内退火形成双链siRNA,或在聚合酶启动子下游设计带发夹结构的表达单位,表达后自身退火形成双链siRNA;③利用载体表达长的dsRNA,多用于果蝇、线虫等低等生物中,在体内表达后被Dicer切割成?21~?23 nt的SiRNA,引发特异地基因表达抑制;或在体外利用Dicer、RNaseⅢ切割dsRNA,产生siRNA,纯化后使用;长的dsRNA在哺乳动物细胞中能激发非特异性反应;但已有研究结果表明在鼠胚胎或胚胎细胞系中,长500 nt的dsRNA也能诱发特异的基因表达抑制。??
5 RNAi技术的应用
依据RNAi现象,科学家建立了RNAi技术,即人为设计合成针对某特定基因序列的dsRNA来关闭或抑制该基因的表达。dsRNA的合成包括化学合成法、体外转录法、转录载体体内转录法等。其中,以DNA为模板体内合成siRNA载体的成功应用,为RNAi的研究提供了更为简便和实用的方法,使RNAi技术真正成为了可被广泛采用的有力工具(Miyagishi等,2002)。?
RNAi技术在基因功能的研究中具有许多传统方法无法比拟的特点和优势。首先,RNAi具有较高的特异性,只引起与dsRNA同源的mRNA降解。RNAi技术中siRNA序列选择余地大,21~23个核苷酸中只要改变1个核苷酸,就可以使该siRNA序列不对靶向mRNA起作用,因此RNAi可用来抑制单个核苷酸突变基因的表达。 ?
5.1 高通量研究基因功能 基因功能研究现在已经明确,双链RNAi技术不仅可抑制体外细胞中特定基因的表达,而且也可抑制体内特定基因的表达。在功能基因组研究中,需要对特定基因进行功能丧失或降低突变,以确定其功能。21 nt siRNA的双链复合物在哺乳动物细胞中干扰成功为基因作用的研究提供了一种新的工具,原来要花费6个月到1年才能明确1个哺乳动物细胞基因如何关闭,现在只需1个星期就能明确10个基因的关闭,使工作进程大大加快。可以预见,RNAi作为一种快速静默基因的途径,将会越来越多地用于哺乳动物基因研究。将功能未知的基因的编码区(外显子)或启动子区,以反向重复的方式由同一启动子控制表达。这样在转基因个体内转录出的RNA可形成dsRNA,产生RNAi,使目的基因静默,从而进一步研究目的基因的功能。根据所选用序列的不同,可将其分为编码区RNAi和启动子区RNAi(Xia等,2002)。线虫和果蝇的全部基因组序列已测试完毕,发现大量未知功能的新基因,RNAi将大大促进对这些新基因功能的研究(Zhang等,2003)。?
5.2 研究信号转导通路的新工具 由于RNAi能高效特异的阻断基因的表达,他成为研究信号传导通路的良好工具。在线虫体内,胰岛素和受体结合后可以活化Dsor1,他是Mek的类似物,Dsor1活化后可以激活EekA,他是ERK的类似物。用以Dsor1为靶目标的dsRNA可以阻断Dsor1的表达,虽然总的ErkA的表达不受影响,但由于Dsor1的表达被抑制,因而胰岛素刺激后ErkA不能活化(Morris等,2002)。
5.3 基因治疗的新方法 用RNAi特异性地抑制如艾滋病病毒基因、肝炎病毒基因、癌基因、癌相关基因或突变基因的过度表达,使这类基因保持在静默或休眠状态,从而有望用这种新的手段治疗各种病毒性疾病和恶性肿瘤等疑难病症。而肿瘤是多基因、多因素疾病,单个癌基因的抑制往往很难达到治疗效果,但RNAi技术能够同时抑制多个不同基因,而且抑制效果互不干扰。此外,RNAi识别可以精确到1个核苷酸,对由野生型点突变形成的癌基因,如ras,p53等,能够产生准确有效的封闭效果,野生型基因则不受影响。试验结果证明,bcl?2、CDK?2、PLK?1和p53等肿瘤相关基因的RNAi,能够使人类宫颈癌细胞(HeLa)增生速度减慢,恶性程度降低,凋亡加快。肝癌(Hep3B)、非小细胞肺癌(H1299)、头颈部鳞状细胞癌(C33?A)、骨肉瘤(U?2OS)及前列腺癌(LNCaP)(Lin等,2001)、白血病(Wilda等,2002)等细胞系中的试验也发现类似效应。此外,将RNAi应用于Wilson病等先天遗传性疾病的体外试验也获得令人满意的结果(Oh等,2002;Hannon等,2004;Celotto等,2004;Tang等,2004;Vi?tei等,2004;Hsieh等,2004;Caplen等,2003;Yoshinari等,2004;Kwong等,2004)。2002年9月,科学家采用这项技术完全清除了生长在试管中的所有癌细胞,而未伤及正常细胞。随着这一研究结果近日的公布,另一个小组的研究人员正设计这一技术在世界上的第一次临床试验,该试验将在一组艾滋病患者中进行。由于双链RNA干涉,通过使有害的基因“静默”而奏效,因而科学家认为,可用其来静默感染的病毒基因或已转为恶性的肿瘤细胞,从而使他们变得无害。?
5.4 反向遗传学上的应用 随着各种模式生物和人类基因组测序的完成,基因功能的研究远远落后于大量序列所提供的信息,研究和发现基因的功能成为越来越紧迫的任务。长期以来,破坏基因结构或抑制基因或基因簇的表达是研究该基因功能的重要方法,如常用的基因敲除技术 (gene knock?out)。基因敲除技术对所研究的基因要有详细的认识,较长的时间才能决定基因与表型的关系。自RNAi现象发现后,因其操作简单,作用迅速,具有较高的特异性,获得了生物学家的青睐,首先应用于反向遗传学和基因功能的研究,尤其是植物和低等生物如病原微生物,能迅速而方便地使某个基因失去功能。因而,能更快的决定基因与表型的关系。RNAi技术还具有的一个优势是能同时对多个基因或基因家族进行研究,或应用于研究mRNA差别剪接形成的异构体,甚至在基因组水平上构建针对基因组的RNAi表达载体,对于研究基因之间的相互作用和进行基因功能的高通量筛查,具有更大的优势。相对于基因敲除技术长期抑制基因功能,RNAi技术仅仅是使基因表达暂时降低或抑制“knock-down”,基因组的信息仍是完整的。利用RNA干扰技术先封闭基因的表达,然后再激活,通过前后基因表型的变化,能很方便的鉴定出基因的功能。?
线虫是研究RNAi现象的最好模式生物,dsRNA可通过浸泡在含dsRNA的溶液中,喂食表达dsRNA的细菌或注射的方式导入线虫体内,诱导RNAi现象。Ahringer等应用RNAi技术研究了秀丽线虫的基因组(覆盖了1/3的基因组),提供了大量的有关线虫发育和生存必需基因的知识。RNAi技术为研究发育过程中基因的功能提供了一个手段,能很容易地制造出突变型个体。Amdam等把dsRNA注入囊胚前期的蜜蜂卵或初生蜜蜂腹内,封闭vitellogenin基因的表达(vitellogenin 基因在成体后才出现表型),结果分别有15%和96%的个体出现突变型。15 d后,仍能检测到dsRNA片段 。在进行反向遗传学研究时,RNA干扰技术也能用来寻找药物治疗靶点,Hideo等利用RNAi技术减少了丘脑下部AGRP(agouti?related peptide)50%的表达量,AGRP使代谢率提高而不用减少摄食量,从而减轻肥胖,为肥胖的治疗提供了一个靶点。用于疾病机理研究,针对Fas 介导的信号通路在肝脏疾病中的作用,在鼠模型中,利用RNAi技术干扰Fas通路能明显降低自身免疫性肝炎引起的肝衰竭和纤维化,说明了Fas通路在肝脏疾病中所起的作用。?
6 问题与展望
RNAi技术有望应用于临床以前,应解决几个问题:①在设计表达siRNA的载体或合成siRNA时,1个碱基的差别将会明显的降低RNAi的效率;另外,Torgeir等研究结果表明,针对mRNA的不同位点,化学合成的siRNA具有不同的诱导RNAi效率,提示在人类mRNA中,能有效诱导RNAi的位点有限,因此要筛选有效位点,确保治疗效果;②siRNA转导入细胞中的效率有待提高,这是RNA干扰技术应用于临床的主要障碍,在培养的细胞中取得较高的转导效率,在体内不一定有这么高的效率,应发展更好更有效的转移载体,能进入细胞内稳定的表达siRNA;③siRNA的稳定性和作用的长期性,siRNA很容易被细胞中的Rnases降解而失效;用DNA质粒和病毒载体表达有茎环结构的siRNA能减少降解,提高RNA干涉的效果和维持较长的作用时间。载体表达的siRNA比化学合成的siRNA具有更高的稳定性,在体内作用也更持久,在将来的基因治疗中,应具有更广阔的应用前景。④各种表达载体或合成RNA的毒性作用还有待研究。?
随着RNAi机理的逐步阐明,RNAi技术正以令人兴奋的速度发展,并不断开辟新的应用领域,各种更好更有效的载体和转移系统的建立,为深入研究和应用提供了前提。RNAi技术在反向遗传学和临床治疗中定会取得更大的成果。?
参考文献
1 Agami R. Curr Opin Chem Biol,2002,6:829~834.?
2 Bernstein E, et al. Nature,2001,409:363~366.?
3 Billy E, et al. Proc Natl Acad Sci USA,2001,98:14428~14433.?
4 Brummelkamp T R, et al. Science,2002,296:550~553.?
5 Caplen N J, et al. Ann N Y Acad Sci,2003,1002:56~62.?
6 Celotto A M, et al. Methods Mol Biol,2004,257:245~254.
7 Elbashir S M, et al. Nature,2001,411:494~498.?
8 Fire A, et al. Nature,1998,391:806~811.?
9 Guo S, et al. Cell,1995,81:611~620.
10 Hannon G J, et al. Methods Mol Biol,2004,257:255~266.?
11 Hsieh A C, et al. Nucleic Acids Res,2004,32:893~901.?
12 Kwong S M, et al. Mol Microbiol,2004,51:497~509.?
13 Lin S L, et al. Biochem Biophys Res Commun,2001,281:639~644.?
14 Miyagishi M, et al. Nucleic Acids Res Suppl,2002,2:113~114.?
15 Morris J C, et al. EMBO J,2002,21:4429~4438.?
16 Oh W J, et al. Eur J Biochem,2002,269:2151~2161.?
17 Sui G H, et al. Proc Natl Acad Sci USA,2002,99:5515~5520.?
18 Svoboda P, et al. Development,2000,127:4147~4156.?
19 Tang G, et al. Methods MolBiol, 2004,257:223~244.?
20 Tuschl T, et al. Biochim Biophys Acta,2002,1575:15~25.?
21 Ui?Tei K, et al. Nucleic Acids Res,2004,32:936~948.?
22 Wilda M, et al. Oncogene,2002,21:5716~5724.
23 Xia H B, et al. Nat Biotechnol,2002,20:1006~1010.
24 Yang S H, et al. Mol Cell Biol,2001,21:7807~7816 .
25 Yoshinari K, et al. Effects on RNAi of the tight structure, sequence and position of the targeted region Nucleic Acids Res,2004,32:691~699.
26 Zamore P D, et al. Cell,2000,101:25~33.
27 Zhang L, et al. Biochem Biophys Res Commun,2003,303:?1169~?1178.
另找了2006年发表的几篇国内综述,
RNAi的抗病毒研究进展
RNA干扰及其抗病毒研究
RNA干扰及其在肿瘤研究中的应用
RNA干扰研究进展
RNA干扰用于基因治疗的研究进展
RNA干扰在肿瘤研究中的进展
基因沉默的新技术:RNA干扰


![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)



