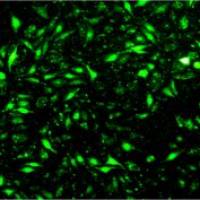
脂质体介导的细胞转染实验
互联网
实验原理
本次实验采用的脂质体是promega公司的TransFast脂质体试剂,它是一种阳离子脂质体和中性脂质体的混合物,是对于本次实验中采用的293T细胞优化的转染试剂。
实验试剂
1. DMEM培养基
2. 链霉素/青霉素(双抗)
3. FCS(小牛血清)
4. PBS(磷酸盐缓冲溶液)
5. 胰酶/EDTA消化液
6. 转染试剂(TransFast)
实验设备
实验材料
1. 293T细胞
2. MyoD表达质粒和EGFP表达质粒
实验步骤
注意事项
6) 培养物污染——培养物可被细菌、酵母、真菌、病毒、支原体、甚至其他细胞种类所污染。各种污染都会导致产生错误的结果。
一般原则:对纯化所得的载体进行质量鉴定。确定维持其正常功能的基因序列是否适合于您的细胞体系。在测定细胞体系的参数时,一定要选用一种已知具有功能的载体做对照。
1) 载体的完整性——载体是否具有功能取决于它结构的完整性。转染效率受到质粒制备物的超螺旋结构和舒展结构之间比例、双螺旋断裂、核酸酶的降解,以及来自于储存和处理过程中的物理压力的影响。
2) 载体制备物——各种载体是按照不同的方案在细菌体系中制备并纯化。制备产物中残余的污染物(如CsCl,内毒素)可能会影响转染效率。