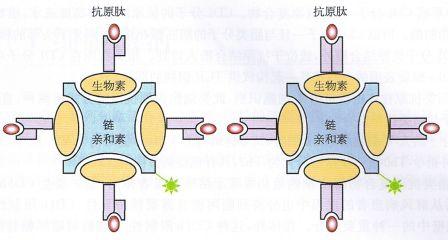
四聚体染色技术
互联网
试剂与设备
1. 待检细胞:PBMC,脾细胞,淋巴结细胞或经过相应病毒感染细胞(注意其HLA-A型别)刺激形成的CTL细胞
2. FACS缓冲液(FB):PBS+2%小牛血清+0.1%叠氮钠
3. 2 X HLA-I/抗原肽四聚体:2倍使用浓度的HLA-I/抗原肽四聚体
4. 1%多聚甲醛(PFA)的PBS
5. 离心机
6. 流式细胞分选仪
7. 加样器、吸头等
操作步骤
1. 将待检细胞悬浮于FACS缓冲液,浓度为5 X 107 细胞/ml。
2. 在微量滴定板中每孔加20μl细胞悬液。
3. 每孔加入20μl 2 X 四聚体试剂,吹打混匀,尽量避免气泡。
4. 在黑暗中冰浴1小时。
5. 加150μl FB,1200rpm离心5分钟。轻轻弹掉上清,也可以用抽吸的方法弃去上清,注意抽吸容易损失细胞,但是可避免有感染性或有害的样本造成污染。
6. 重复洗涤2次,方法同步骤5。
7. 用含1%多聚甲醛(PFA)的PBS 200μl 重悬细胞。PFA似乎可以增加一些“绿色”荧光标记的检出率。
8. 用FACS检测。
注意事项
1. 为了节省试剂,应设法使染色反应的体积尽可能小。通常加20μl的2X 四聚体试剂于20μl的2 X 细胞悬液,总体积为40μl。这仅作参考,可以根据实际情况调整反应体积。
2. 所有的染色反应都应在4℃进行。有时在室温下的染色强度更高。但有些表面标记对高温较敏感,特别是CD62L。
3. 在作较大规模实验时,应先测试剂的效价。上述制备的四聚体常用的最终稀释度为1:100。
4. 对于某些四聚体(但不是大多数),染色时可能观察到CD8介导的粘附,即四聚体结合到所有CD8+ 细胞上。这种CD8介导的粘附(暂且称其为非特异性粘附)能够通过加入CD8抗体阻断。
5. 对于新鲜淋巴细胞(PBMC,淋巴结,脾细胞),通常用1-2 X 106 细胞进行染色。对于细胞克隆和CTL细胞系,也许用2 X 105细胞也可能获得满意的染色效果。当对某个细胞克隆进行染色时,最好加入特异性不同的另一细胞克隆作为阴性对照。通常采用的比例为:特异性克隆:非特异性克隆=10:90。
![DiR' [DiIC18(7)],用于膜染色,100068-60-8,≥95%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/894/0610600261090733081.jpg!wh200)